
Le informazioni di questa pagina sono state prese dal sito www.oftal.it del dott. Fabio Amorelli


Le informazioni di questa pagina sono state prese dal sito www.oftal.it del dott. Fabio Amorelli
Glaucoma primario ad angolo aperto (GPAA)
Questa forma, che in passato veniva chiamata correntemente "Glaucoma Cronico Semplice", é di gran lunga la più frequente ed insidiosa.
Anche se esistono molti casi sporadici é oggi evidente che essa é fortemente condizionata da fattori ereditari.
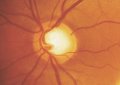
L'ipertensione oculare, coadiuvata da altri fattori che aumentano la vulnerabilità dei tessuti, inizia insidiosamente il danneggiamento del nervo ottico. Un certo numero di fibre entra in sofferenza sino ad essere distrutte. Se non viene istituita in tempo la terapia adatta ne consegue una progressiva lesione del nervo ottico (papilla ottica). In questa struttura la escavazione centrale che é presente anche in molti occhi normali va via via sempre più allargandosi a spese del tessuto nervoso normale. Nelle fasi avanzate la papilla ottica appare atrofica e caratteristicamente escavata a pentola.
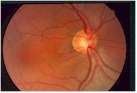
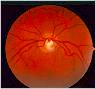
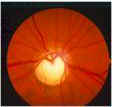
La malattia colpisce soprattutto pazienti di età superiore ai 40 anni ed è più frequente tra le persone nella cui famiglia si sono verificati altri casi.
Esiste una varietà più chiaramente eredo familiare della malattia che colpisce anche soggetti giovani. Fra i miopi elevati il GPAA è frequente anche in età giovanile.
Caratteristiche principali di questo tipo di glaucoma sono dunque il suo decorso insidioso senza sintomatologia, l'aumento graduale e non violento della pressione oculare, lo svilupparsi di una atrofia del nervo ottico con escavazione papillare e l'instaurarsi di progressivi difetti del campo visivo.
Il GPAA (Glaucoma Primario ad Angolo Aperto) é una malattia comunque grave, che se non viene curata può portare nel tempo lungo alla cecità, tuttavia è ben curabile sia con mezzi farmacologi che chirurgici. Se la corretta terapia viene instaurata in tempo il suo decorso viene arrestato e la funzione visiva viene conservata.
 |
 |
 |
Con la importante eccezione del glaucoma acuto da chiusura d'angolo e di alcune forme secondarie, la maggior parte dei glaucomi ha andamento cronico e molto subdolo caratterizzato per lungo tempo dalla assoluta mancanza di disturbi soggettivi.
Il paziente gode di un apparente benessere e non é spinto a rivolgersi all'oculista. Questo stato di cose comporta il pericolo che una diagnosi precoce non venga fatta e che ci si accorga della presenza della malattia soltanto nelle fasi molto avanzate quando i danni irreversibili hanno già raggiunto una notevole gravità.
Per evitare questa drammatica evenienza é necessario che la malattia venga ricercata sistematicamente fra le persone che hanno maggiore probabilità di soffrirne.
Poiché nella grande maggioranza dei casi il primo segno é presenza di una ipertensione oculare il provvedimento fondamentale sarà appunto la misurazione della pressione intraoculare (tonometria). Essa sarà sempre associata alla osservazione oftalmoscopica dello stato della papilla ottica per identificare anche i meno numerosi casi di glaucoma a pressione normale.
Queste due semplici indagini, non invasive, rapide e poco costose, permetteranno di identificare i casi sospetti che saranno poi inviati ad accertamenti più approfonditi.
Una volta che sia stato avanzato il sospetto la diagnosi del glaucoma é abbastanza facile. Essa si basa su alcuni capisaldi che sono alla portata di qualsiasi buona struttura oculistica.
Sulla base di queste indagini la diagnosi di glaucoma può essere stabilita od esclusa con ragionevole certezza.
Ai fini della massima efficienza di questa opera di ricerca sistematica dei casi sospetti, devono essere sottoposti alle due indagini citate le popolazioni a maggior rischio che sono le seguenti.
L'efficacia di questo comportamento é garantito dai seguenti fatti.
L'unico sanitario che puo' effettuare una diagnosi precoce del
glaucoma e' l'oculista. Nel corso della visita i parametri che devono essere
controllati sono essenzialmente tre:
1) la pressione intraoculare. Con il tonometro puo' essere valutata
la pressione all'interno del globo oculare in modo da individuare
tempestivamente un eventuale aumento.
2) l'aspetto del nervo ottico. Con l'oftalmoscopio il nervo ottico
puo' essere osservato direttamente dallo specialista: nel caso del glaucoma
si evidenzia anche un danno iniziale
3) la perimetria computerizzata. E' un moderno metodo di indagine con
cui si misura la sensibilita' retinica nelle diverse zone della retina. Cio'
permette di identificare precocemente i danni e valutare l'efficacia della
terapia molto meglio che con i precedenti metodi di perimetria.
Abbiamo già detto che la pressione oculare normale è compresa fra i 10 ed i 21 mm/Hg con una media di 16 mm/Hg.
Pressioni più elevate possono portare alla lesione del nervo ottico, come accade nei vari tipi di glaucoma. Non è detto tuttavia che pressioni superiori al limite della normalità statistica siano di per se necessariamente lesive. L'insorgere del danno è molto condizionato dal grado di vulnerabilità individuale del nervo ottico. In altre parole vi sono individui che possono tollerare indefinitamente senza danni pressioni piuttosto elevate, mentre altri sviluppano una lesione glaucomatosa anche a livelli di ipertensione molto modesti. Per questa ragione il riscontro di una ipertensione oculare moderata non significa che siamo in presenza di un glaucoma.
Non va tuttavia dimenticato che la ipertensione oculare é il principale fattore di rischio per il glaucoma e che il rischio aumenta progressivamente con l'aumentare del livello pressorio.
In una popolazione non selezionata si ritrova un certo numero di individui la cui pressione oculare è superiore ai 21 mm/Hg senza che siano dimostrabili danni del nervo ottico e della funzione visiva neanche in fase molto iniziale.
Questi soggetti che chiamiamo ipertesi oculari appartengono alla popolazione degli ipertesi oculari
Non é possibile, con i mezzi diagnostici attuali, prevedere quali di questi soggetti, svilupperà la malattia ed i danni ad essa legati e quali no.
Al fine di orientare il comportamento pratico si possono utilizzare alcuni fattori di rischio. Quando il rischio è considerato troppo elevato il trattamento è giustificato.
|
Fattori di rischio per il glaucoma
primario ad angolo aperto (GPAA): |
Normalmente in un ambulatorio oculistico di medio livello
si ha molto più spesso a che fare con pazienti diagnosticati come sospetto
glaucoma, che con pazienti che realmente presentano alterazioni glaucomatose.
I dati anamnestici e le diagnosi che non possono essere interpretati in modo
chiaro, i pazienti ansiosi, e in taluni casi la preoccupazione dell'oculista
curante di garantire una sicurezza assoluta al paziente, sono la causa del
fatto che un considerevole numero di pazienti viene trattato con colliri
antiglaucomatosi senza che in realtà essi soffrano di difetti accertati del
campo visivo o di alterazioni glaucomatose della papilla. L'approccio che
usiamo e i provvedimenti che prendiamo nel caso di persone, cui sia stato
diagnosticato un sospetto glaucoma, dovrebbero indubbiamente avere lo scopo
di prevenire alterazioni indotte dal glaucoma. Tuttavia, ogni paziente
portatore di qualche fattore di rischio ha veramente bisogno di una terapia?
D'altra parte, molte persone sono affette da glaucoma senza esserne in realtà
consce. Per lo più, essi sono portatori di uno o svariati fattori di
rischio, ma non si sottopongono ad un controllo oftalmologico abbastanza
tempestivamente. In molti di questi casi la diagnosi sarà posta solo dopo
che un evidente peggioramento delle funzioni visive si è già instaurato.
Quale fattore di rischio giustifica una diagnosi di glaucoma sospetto e come
dovrebbero essere controllati pazienti di questo tipo nel periodo
successivo? Per aiutarci a trovare risposte a queste domande abbastanza
intriganti, qui di seguito cercheremo di chiarire quali sono i fattori di
rischio importanti e il loro significato, così come il modo con il quale
l'oculista curante dovrebbe affrontare i casi di glaucoma primario ad angolo
aperto (GPAA).
PRESSIONE INTRAOCULARE
La pressione intraoculare (PIO), che - a parte i test diagnostici sulla
papilla e sul campo visivo - era abitualmente impiegata come criterio
basilare nella diagnosi di glaucoma, è stata ricondotta a ruolo di semplice
fattore di rischio a partire dal momento in cui si è riscontrato che anche
i fattori vascolari da soli possono far rapidamente peggiorare una lesione
glaucomatosa tipica. Ciò nonostante la PIO è considerata il più
importante tra tutti i fattori di rischio.
E' difficile dare una definizione di pressione intraoculare
"normale". I valori più largamente accettati sono fondati su
studi molto estesi condotti da Leydhecker nel 1958. In screening di massa su
20.000 occhi normali è stata riscontrata una PIO media di 15,5 mmHg (D.S.
± 2,57). Sono stati definiti come sospetti di presentare un glaucoma occhi
con una PIO compresa entro il limite superiore del doppio della deviazione
standard (20,5 mmHg); mentre occhi con una PIO oltre il triplo della
deviazione standard (> 23 mmHg) sono stati considerati sofferenti di
glaucoma. Pertanto PIO e glaucoma sono diventati quasi sinonimi. Ulteriori
studi tuttavia hanno dimostrato che la distribuzione della PIO nella
popolazione sana non corrisponde ad una "curva di distribuzione di tipo
gaussiano", ma risulta spostata a destra verso i valori di pressione più
alti. Il 5-10% della popolazione ultra quarantenne ha una PIO maggiore di 22
mmHg, mentre in un significativo numero di questi pazienti non sono
riscontrabili né alterazioni papillari di tipo glaucomatoso né difetti del
campo visivo. Se questi pazienti sono controllati nel tempo, ogni anno
circa, il 2% di essi sviluppa alterazioni del campo visivo di tipo
glaucomatoso. I pazienti con una PIO = 30 mmHg hanno un 30% di probabilità
che entro 5 anni si evidenzino alterazioni glaucomatose.
Inoltre le variazioni circadiane di pressione non dovrebbero essere
sottovalutate. Variazioni della PIO > 5 mmHg sono più frequenti in occhi
glaucomatosi e dovrebbero pertanto portare a far praticare adeguati
controlli diagnostici.
I controlli clinici in caso di sospetto glaucoma dovrebbero comprendere una
misura della pressione della PIO 4 volte l'anno ed una perimetria
computerizzata con rilievo documentale della papilla almeno una volta
all'anno.
In accordo con le raccomandazioni delle "Linee guida Europee" una
terapia dovrebbe essere instaurata quando si riscontrano ripetutamente
valori di 30 o più mmHg, anche se non si evidenziano fattori di rischio.
Questo valore, tuttavia, dovrebbe essere considerato solo come un aiuto a
titolo d'orientamento. In casi particolari, per esempio, qualora siano
presenti fattori di rischio o si tema una scarsa compliance del paziente, può
essere necessario iniziare la terapia con valori di pressione di gran lunga
inferiori.
ETA'
E' noto che il glaucoma primario ad angolo aperto è una patologia che
colpisce gli strati più anziani della popolazione. L'incidenza dei difetti
glaucomatosi del campo visivo in soggetti al di sotto dei 40 anni è dello
0.7%, mentre sale al 4.8% al di sopra dei 60 anni. Finora non sono state
chiarite le cause di questo aumento d'incidenza, ma a parte il fatto che nei
pazienti anziani si riscontrano normalmente valori di PIO più alti, si
sospetta che contribuiscano a quest'aumento anche alterazioni tissutali
correlate all'età. Inoltre non si dovrebbe dimenticare che esistono dei
particolari tipi di glaucoma nei quali l'inizio della malattia spesso si
verifica molto prima dell'età di 40 anni, come per esempio in casi di
glaucoma pigmentario.
Gli screening per il glaucoma fondati sui rilievi della PIO non hanno mai
mostrato un favorevole rapporto costo-beneficio, ma la PIO deve essere
misurata in quei pazienti ultra quarantenni che si recano da un oculista.
RAZZA
E' ben nota la maggiore incidenza di questa malattia in soggetti di razza
nera e caraibica. Tuttavia esiste un solo studio nel quale soggetti di razza
nera e di razza bianca siano stati esaminati tenendo conto delle
corrispondenti classi d'età e con le stesse metodiche, il cosiddetto "Baltimore
Eye Survey". Questo studio ha dimostrato che il rischio di sviluppare
un glaucoma per soggetti americani di razza nera era 4.3 volte maggiore
rispetto a quelli di razza bianca. Di conseguenza anche un'ulteriore
evoluzione della malattia è solitamente più sfavorevole nei neri. Le cause
di ciò non sono chiare.
FAMILIARITA' E GENETICA
La domanda se qualcuno dei parenti soffre di glaucoma dovrebbe essere
d'obbligo nelle anamnesi per glaucoma, da che è nota l'alta incidenza di
glaucoma cronico semplice in taluni alberi genealogici. Il meccanismo della
familiarità di per sé è ancora poco chiaro; tuttavia il rischio di
sviluppare la malattia è da 3 a 6 volte più alto per chi ha parenti di
primo grado con glaucoma.
Le ricerche genetiche riguardanti il glaucoma sono un campo di studio
veramente promettente. Sino ad ora sono stati individuati 17 geni che
potrebbero essere in causa nella genesi di vari tipi di glaucoma. Per 6 di
essi è stata posta una correlazione con il GPAA, tutti gli altri invece con
forme malformative per esempio la sindrome di Axenfeld e quella di Rieger,
l'aniridia, la dispersione pigmentaria. Nel GPAA e nel glaucoma da
pseudoesfoliazione si riscontrano mutazioni genetiche multiple. In futuro,
test diagnostici sul DNA saranno verosimilmente utilizzabili non solo per
valutare il rischio glaucomatoso ma anche per scegliere tra diverse opzioni
terapeutiche nei singoli pazienti.
MIOPIA E DIABETE: FATTORI DI RISCHIO MEDIO
In varie ricerche si è riscontrata un'aumentata incidenza di glaucomi sia
in pazienti affetti da miopia media e grave, sia in pazienti diabetici. In
essi l'aumentata prevalenza rispetto alla popolazione normale è stata
valutata senza tener conto del fatto che, in linea generale, i miopi e i
diabetici sono più portati a farsi visitare da un oculista; pertanto è
verosimile che il loro numero sia sovrastimato. Un possibile meccanismo
patogenetico è un'alterazione della matrice extracellulare e del tessuto
connettivale nelle strutture trabecolari. Inoltre, nei pazienti diabetici
una microangiopatia contribuisce a far peggiorare la microcircolazione
papillare.
IPERTENSIONE ARTERIOSA, EMICRANIA E VASOSPASMO: FATTORI DI RISCHIO
DEBOLE
Benché alcune pubblicazioni abbiano dimostrato un'associazione positiva tra
PIO e pressione arteriosa, tale dato non ha potuto essere confermato da
studi relativi ad ampi strati della popolazione, quali il Framingham o il
Baltimore Eye Survey, con i quali esistono rilievi decisamente discordi. Uno
studio ha dimostrato un'associazione stretta e statisticamente significativa
tra ipertensione arteriosa non trattata e GPAA, ma d'altro canto nello
stesso studio pazienti con ipertensione arteriosa trattata non erano a
maggior rischio di glaucoma rispetto al gruppo di controllo. Anche se sembra
ragionevole ritenere, dal punto di vista biologico, che un'ipertensione
arteriosa danneggi la circolazione capillare e riduca la perfusione della
papilla, le risultanze contraddittorie e la debole associazione non
consentono di classificare l'ipertensione arteriosa se non come fattore di
rischio debole.
Alterazioni transitorie del flusso ematico oculare - per esempio in
connessione con un'emicrania od un vasospasmo periferico - sono state
sospettate di essere la causa di sviluppo di un glaucoma. Sembra credibile
che una cattiva perfusione della testa del nervo ottico comporti lo sviluppo
di una neuropatia ottica glaucomatosa, ma non sono state riscontrate
differenze nella prevalenza d'emicrania tra pazienti glaucomatosi con PIO
elevata o normale e controlli sani.
Per riassumere, si può dire che un'anamnesi completa, associata ad
un'accurata visita oftalmologica dovrebbe essere sempre condotta
separatamente in ogni singolo caso. Dopotutto, a rispetto di ogni sforzo per
identificare fattori di rischio utilmente curabili, non rimane alcun altro
fattore di rischio sicuramente provato, oltre ad un ipertono oculare che
possa essere trattato in modo soddisfacente.
La decisione se iniziare o no una terapia, tuttavia, deve fondarsi sull'età
del paziente, sulle sue aspettative di vita e sulla sua qualità di vita.

La gonioscopia è una parte essenziale dell'esame iniziale di ogni paziente con sospetto di glaucoma. Allo scopo di riconoscere tanto le ragioni più comuni quanto quelle meno frequenti che impediscono il deflusso dell'umore acqueo, l'esaminatore ha bisogno di un esercizio costante sia su occhi normali che patologici.
Caratteristiche più importanti da identificare
Reperti patologici
|
Introduzione
I glaucomi sono un gruppo di alterazioni caratterizzate da manifestazioni
cliniche e patologiche eterogenee. Per poter porre una diagnosi corretta e
impostare una gestione del paziente appropriata, è essenziale poter
esplorare l'angolo camerulare mediante l'impiego della gonioscopia. Poiché,
per essere efficace, la terapia per ciascun tipo di glaucoma deve essere
specifica, è importante determinare il meccanismo responsabile
dell'alterato deflusso dell'acqueo attraverso le maglie trabecolari. La
tecnica gonioscopica può essere padroneggiata solo con una pratica
continua, sia su occhi normali che patologici.
Tecniche di Gonioscopia
L'angolo della camera anteriore non può essere visualizzato direttamente
attraverso la cornea integra, perché i raggi luminosi emessi dalle
strutture angolari subiscono una riflessione interna totale. Una goniolente
elimina la riflessione totale interna in quanto sostituisce l'interfaccia
cornea-aria con una nuova interfaccia, che ha un indice di rifrazione più
elevato di quello della cornea. Ci sono due modi fondamentali di effettuare
una gonioscopia: la gonioscopia diretta, che consente una visione diretta
dell'angolo, e la gonioscopia indiretta, che fornisce un'immagine speculare
della porzione opposta dell'angolo. Queste sono di gran lunga le tecniche più
comunemente in uso. Una gonioscopia indiretta può essere praticata usando
sia una lente di Goldmann, sia una lente di Zeiss.
Gonioscopia con lente di Goldmann:
Questa tecnica è relativamente facile da effettuare e dà una visione
eccellente delle strutture dell'angolo.
Per adattare le interfacce è necessario impiegare una sostanza viscosa che
consente un'immagine stabile, ma provoca per contro un annebbiamento visivo.
Quando la visione dell'angolo è ostacolata da un'iride convessa, si può
vedere di sopra dell'ostacolo chiedendo al paziente di guardare nella
direzione dello specchio. Al contrario, quando la superficie dell'iride è
piatta, si può ottenere una visione parallela al piano dell'iride, con una
qualità dell'immagine ottimale, chiedendo al paziente di guardare nella
direzione opposta allo specchio.
Gonioscopia con lente di Zeiss:
La lente di Zeiss (e quella di Posner, abbastanza simile) è una goniolente
a quattro specchi, che è sostenuta da un manico. Non è richiesta una
sostanza viscosa nell'interfaccia, il che permette un esame dell'angolo più
rapido e più comodo e non provoca come conseguenza una visione annebbiata.
Il vantaggio maggiore di questa tecnica è quello che può essere usata per
una gonioscopia con indentazione, per cui l'umore acqueo è spinto nella
parte periferica della camera anteriore, forzando l'angolo ad aprirsi e
permettendo, quando l'angolo è stretto, la visualizzazione del recesso
angolare. Se l'angolo è chiuso da aderenze tra iride periferica e cornea
(chiusura da sinechie) le strutture dell'angolo rimarranno non esplorabili.
Con l'esperienza, una delicata gonioscopia ad indentazione permette una
migliore visualizzazione anche di angoli normali (Fig. 1).
 |
|
Fig. 1 |
Identificazione delle strutture dell'angolo (Fig. 2)
 |
|
Fig. 2 |
E' importante che l'esaminatore abbia familiarità con
la morfologia normale dell'angolo e sia in grado di identificarne ogni
struttura.
Banda ciliare:
La struttura più posteriore appare di un colore variabile da rosa a
marrone opaco a grigio ardesia. La sua ampiezza dipende dalla posizione
dell'inserzione dell'iride; tende ad essere più sottile in occhi
ipermetropi, e più larga in occhi miopi. Il recesso angolare è
costituito dalla radice dell'iride dove essa si inserisce nel corpo
ciliare.
Sperone sclerale:
E' la proiezione più anteriore della sclera ed é il punto di inserzione
del muscolo longitudinale del corpo ciliare. Gonioscopicamente, lo sperone
sclerale è situato appena posteriormente al trabecolato ed appare come
una banda stretta densa, di colorito biancastro spesso lucente.
Costituisce il punto di repere più importante, perché ha un aspetto
relativamente costante in occhi diversi.
Maglia trabecolare:
Si estende dallo sperone sclerale alla linea di Schwalbe. La porzione
posteriore funzionale adiacente allo sperone sclerale è pigmentata ed ha
un aspetto blu-grigiastro traslucido. La porzione anteriore, non
funzionante, è adiacente alla linea di Schwalbe e ha un colore
biancastro. Una pigmentazione del trabecolato è rara prima della pubertà.
La linea di Schwalbe:
E' la struttura più anteriore ed appare come una linea opaca.
Anatomicamente, essa rappresenta il limite periferico della membrana di
Descemet ed il limite anteriore del trabecolato.
Valutazione delle strutture angolari
La valutazione dell'ampiezza dell'angolo è una parte essenziale
dell'esame dell'occhio. Essa è importante per determinare:
Sistema di valutazione secondo Shaffer (Fig. 3)
 |
|
Fig. 3 |
Il sistema di valutazione dell'angolo che oggi è usato quasi universalmente è stato introdotto da Shaffer e registra in gradi d'arco l'angolo sotteso dalla superficie più interna del trabecolato e la superficie anteriore dell'iride, a circa un terzo della distanza dalla sua periferia. Una valutazione dell'ampiezza dell'angolo si ottiene osservando l'entità della separazione tra due linee immaginarie tangenti rispettivamente una alla superficie più interna del trabecolato e l'altra alla superficie anteriore dell'iride. In pratica, l'esaminatore classifica l'angolo a seconda della visibilità delle sue diverse strutture. Il sistema di classificazione di Shaffer offre un metodo per comparare le ampiezze di differenti angoli camerulari. Il sistema assegna un valore numerico a ciascuno angolo, associando ad esso una descrizione anatomica, l'ampiezza dell'angolo in gradi e la conseguente interpretazione clinica.
Allo scopo di comparare i reperti in indagini
epidemiologiche diverse, un angolo "occludibile" è considerato
quell'angolo nel quale la parte pigmentata del trabecolato non è visibile
su tre quadranti della circonferenza, se non si pratica una indentazione o
altra manipolazione.
Reperti patologici
Sinechie periferiche anteriori
Le sinechie periferiche anteriori (SPA) sono aderenze della radice
dell'iride al trabecolato. E' importante distinguere tra SPA, nelle quali
l'iride è sollevata a tenda da adesioni al trabecolato (Fig. 1), ed i
processi iridei, che sono una variante anatomica normale. I processi
iridei sono corde merlettate di tessuto uveale che vanno dall'iride al
trabecolato, sono molto rilevate nell'infanzia e negli occhi marroni e
tendono ad attenuarsi e a perdere la loro continuità con l'età. Le SPA
possono essere causate da una chiusura dell'angolo per adesione, da una
chiusura dell'angolo strisciante, da infiammazioni, da membrane
neovascolari, da migrazione di cellule dell'endotelio corneale (Sindrome
Endoteliale Irido-Corneale, o ICE), e da traumi.
Il glaucoma ad angolo chiuso cronico è un'alterazione anatomica del
segmento anteriore dell'occhio, caratterizzata da una chiusura permanente
di parte dell'angolo filtrante, come risultato di un'apposizione
dell'iride al trabecolato. L'aumento conseguente della pressione intra
oculare può causare un'alterazione del nervo ottico, che non è
distinguibile da quella che si riscontra nel glaucoma cronico ad angolo
aperto. Nelle popolazioni cino-mongoliche questo tipo di glaucoma è più
comune del glaucoma cronico ad angolo aperto ed è la causa più
importante di cecità prevenibile dell'età senile negli asiatici dell'Est
e del Sud-Est . La terapia del glaucoma ad angolo chiuso cronicizzato è
sostanzialmente diversa da quella del glaucoma ad angolo aperto cronico.
Ci sono due vie per arrivare ad un glaucoma ad angolo chiuso cronico, che
possono essere distinte mediante gonioscopia. Nel primo caso, un bombé
dell'iride da blocco pupillare relativo causa una chiusura dell'angolo per
apposizione. Un'apposizione prolungata o degli attacchi subacuti ripetuti
portano alla formazione graduale di SPA , che comincia nella parte
superiore dell'angolo. Le sinechie inizialmente sono strette e arrivano
sino a metà della trama del trabecolato; poi, si espandono gradualmente.
Non in tutti i casi si formano SPA permanenti e una chiusura cronica può
condurre ad una pressione intra oculare elevata e ad un danno di tipo
glaucomatoso.
Il secondo modo di arrivare ad una progressiva chiusura cronica
dell'angolo è la cosiddetta chiusura "strisciante" dell'angolo
(Fig. 4). La chiusura dell'angolo è circonferenziale e comincia nella
porzione più profonda dell'angolo. Benché la chiusura avvenga più
raramente che con il blocco pupillare, spesso si ha una lieve asimmetria e
la parte superiore dell'angolo di solito è interessata prima di quella
inferiore. Con l'andar del tempo, l'aspetto è quello di un'inserzione
dell'iride più anteriore, via via che le sinechie periferiche anteriori
gradualmente strisciano sulla superficie della banda ciliare per
raggiungere prima lo sperone sclerale e poi il trabecolato filtrante.
Quando le SPA occludono il trabecolato in modo permanente, la pressione
intra oculare aumenta e si può instaurare un danno glaucomatoso. C'è una
relazione lineare tra l'estensione in quadranti della chiusura permanente
ed il livello della pressione intra oculare.
Le sinechie periferiche anteriori di tipo infiammatorio tendono ad avere
una base larga e si formano più frequentemente nell'angolo inferiore, a
causa della localizzazione dei leucociti. Nella sindrome ICE le sinechie
periferiche anteriori possono portarsi al davanti della linea di Schwalbe,
un evento insolito in altre condizioni.
 |
|
Fig. 4 |
Dispersione del pigmento
Una pigmentazione eccessiva del trabecolato può essere riscontrata nella
sindrome da dispersione di pigmento, nel glaucoma pigmentario, nella
sindrome da pseudoesfoliazione capsulare, nelle uveiti e nei traumi; può
essere secondaria a melanoma ed a cisti epiteliali pigmentate e può
essere un reperto tipico in caso di dispersione del pigmento nel soggetto
pseudofachico.
La sindrome di dispersione del pigmento è di solito una condizione
bilaterale caratterizzata dalla liberazione di granuli di pigmento
dall'epitelio pigmentato dell'iride e dalla loro deposizione in tutto il
segmento anteriore, inclusi zonula e corpo ciliare. L'aumento della
pressione oculare è causato dalla ostruzione provocata dal pigmento negli
spazi inter-trabecolari e dalla alterazione delle travate trabecolari. E'
stato ipotizzato che l'inarcamento posteriore della radice dell'iride sia
causato da un blocco pupillare "inverso", nel quale un aumento
transitorio e relativo nella pressione nella camera anteriore rispetto a
quella posteriore determina uno spostamento indietro dell'iride e provoca
un contatto irido-zonulare. Questa ipotesi è sostenuta dall'osservazione
che l'entità di dispersione del pigmento può essere diminuita invertendo
la concavità dell'iride con miotici o con iridotomia laser. La
gonioscopia mostra un angolo molto ampio, con una concavità dell'iride
periferica vicino alla sua inserzione ed una iper-pigmentazione del
trabecolato. La pigmentazione è più marcata sopra la porzione posteriore
del trabecolato e forma una banda densa che interessa uniformemente tutta
la circonferenza del trabecolato. Nella maggior parte dei casi, la linea
di Schwalbe è fortemente pigmentata, col pigmento più addensato
inferiormente, e che diminuisce sino a scomparire superiormente. Di quando
in quando, un ulteriore leggero deposito di pigmento può essere visto al
davanti della linea di Schwalbe nell'angolo inferiore.
Nella sindrome da pseudoesfoliazione, la gonioscopia mostra una
iperpigmentazione del trabecolato, più marcata inferiormente (Fig. 5). Il
pigmento è posto sulla superficie del trabecolato ed ha una distribuzione
a chiazze. E' anche frequente osservare una banda di pigmento a profilo
ondulato al di sopra o al davanti della linea di Schwalbe (linea di
Sampaolesi). Materiale pseudoesfoliativo può essere visto sulle maglie
del trabecolato ed in alcuni casi l'angolo può essere stretto. Poiché
questa forma di glaucoma avanza più rapidamente che un glaucoma primario
ad angolo aperto, la gonioscopia può fornire un indizio precoce per la
diagnosi perché i segni di dispersione del pigmento possono precedere la
scoperta di materiale pseudoesfoliativo.
 |
|
Fig. 5 |
Vasi neoformati
Vasi sanguigni possono essere visibili normalmente nell'angolo camerulare
(vasi nell'angolo sono visibili gonioscopicamente nel 62% dei soggetti con
occhi blu e nel 9% di quelli con occhi marrone). Comunque, come regola
generale, qualsiasi vaso sanguigno che attraversa lo sperone sclerale
sopra la maglia trabecolare di solito è anomalo.
In pazienti con occlusione acuta della vena centrale della retina, se non
si pratica una gonioscopia, c'è un rischio significativo di non
individuare una neovascolarizzazione del segmento anteriore (Fig. 6). In
pazienti con neoformazione vascolare iniziale, una pressione anche leggera
sulla gonio-lente è sufficiente per far collassare questi ciuffi
neovascolari e renderli non più visibili all'osservatore. Nel diabete, è
sicuramente meno comune che i vasi neoformati nell'angolo compaiano prima
di quelli sull'iride.
Nella ciclite eterocromica di Fuchs può essere visibile nell'angolo una
fine neovascolarizzazione. Questi vasi possono attraversare lo sperone
sclerale sopra la trama trabecolare.
 |
|
Fig. 6 |
Traumi
La gonioscopia è particolarmente importante in pazienti che abbiano in
precedenza subito un trauma contusivo. Solo mediante gonioscopia è
possibile evidenziare una recessione dell'angolo, una dialisi trabecolare
ed una ciclodialisi. Inoltre, con questa tecnica è possibile osservare
l'eventuale presenza di piccoli corpi estranei nell'angolo. Questi reperti
hanno importanti implicazioni medico-legali.
Una recessione dell'angolo è caratterizzata da un marcato allargamento
della banda ciliare. La sclera denudata può essere visualizzata e lo
sperone sclerale si evidenzia come un linea bianca brillante (Fig. 7). E'
importante la valutazione comparativa di aree gonioscopiche dello stesso
occhio e comparare l'occhio patologico con l'occhio controlaterale
normale. Una recessione d'angolo è il segno più comune di una lesione
post-traumatica dell'occhio e circa il 9% di questi pazienti svilupperà
un glaucoma come complicazione tardiva. è importante porre la diagnosi di
glaucoma post-traumatico da recessione d'angolo perché in questi casi una
trabeculoplastica con argon laser di solito non ha successo nel
controllare la pressione intra oculare. In più, un glaucoma da recessione
dell'angolo è un fattore di rischio significativo di mancato
funzionamento della bozza dopo trabeculectomia e la presenza di questa
alterazione strutturale di solito implica che in caso di intervento
fistolizzante dovrebbe essere usato un anti-metabolita.
In un paziente con una ciclodialisi post-traumatica, la camera anteriore
è poco profonda e la pressione intra oculare è bassa. Mediante
gonioscopia ad indentazione, è possibile determinare la posizione esatta
della fessura. Tutti i metodi attualmente impiegati per chiudere una
fessura da ciclodialisi si fondano sulla conoscenza esatta della sua
posizione.
|
|
Conclusioni
La gonioscopia richiede destrezza ed è una parte essenziale dell'esame
del paziente glaucomatoso. Solo praticando una gonioscopia su ogni
paziente con glaucoma il clinico acquisirà familiarità con la varietà
di reperti normali e patologici che possono essere presenti. La causa più
comune di una diagnosi non corretta è l'omissione di una gonioscopia da
parte di un esaminatore che illazioni che, se l'esame alla lampada a
fessura non evidenzia né un angolo stretto, né un'infiammazione oculare,
né una neoformazione vascolare, né esiti di traumi precedenti, il
glaucoma in quel paziente "deve" avere un meccanismo
patogenetico ad angolo aperto. Il glaucoma da chiusura d'angolo
cronicizzato e molte altre forme di glaucoma in questo caso possono non
essere identificati. Una volta conosciuta la causa esatta del glaucoma può
essere istituita una terapia specifica.

Una valutazione combinata della papilla ottica e del campo visivo è il punto chiave della diagnosi del glaucoma. Mentre valutare una papilla resta tuttora molto soggettivo, l'automazione della perimetria ha reso disponibili diversi procedimenti d'interpretazione computerizzata. Anche se tali procedimenti possono sembrare complicati, essi si fondano su conoscenze vecchie di almeno cent'anni. Quanto esposto più oltre cercherà di chiarire i fondamenti strutturali dei difetti del campo visivo tipici del glaucoma; inoltre sarà descritto come l'interpretazione computerizzata possa essere utilmente impiegata nella moderna diagnosi di glaucoma.
I difetti del campo visivo nel glaucoma:
|
Albrecht Von Graefe nel 1856 (1) descrisse per primo le alterazioni del campo visivo nel glaucoma; 10 anni dopo egli evidenziò la conservazione delle regioni temporale e centrale nel glaucoma avanzato. Successivamente Bjerrum 1889 (2) e Rönne 1909 (3) evidenziarono la presenza di difetti arcuati del campo visivo e di "salti" nel settore nasale. Inoltre, essi scoprirono che tali difetti spesso erano di tipo relativo, vale a dire che nelle zone deficitarie permaneva un certo grado di visione. In uno studio di ampie dimensioni del 1967, Aulhorn e Harms dimostrarono l'importanza di difetti paracentrali come sintomo precoce di glaucoma (4). Ancora oggi è in uso il loro esaustivo sistema di classificazione, fondato sullo studio del campo visivo di 2684 occhi glaucomatosi (vedi tabella 1).
|
Tabella 1: Classificazione delle
alterazioni |
|
Basi microanatomiche delle diverse categorie di alterazioni perimetriche glaucomatose
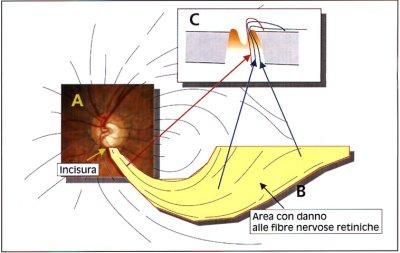 |
|
Fig. 1: Un'incisura localizzata al polo inferiore della papilla (A) riflette un danno alle fibre nervose retiniche che decorrono in modo arciforme (B) dando come risultato un difetto arciforme del campo visivo. Una sezione della papilla (C) evidenzia come fibre nervose provenienti da aree peripapillari (freccia rossa) sono situate centralmente nel nervo ottico, mentre fibre provenienti da aree periferiche (freccia verde) sono localizzate vicino alla guaina del nervo. Un'alterazione situata a metà strada tra la sclera e l'escavazione papillare comporta un difetto paracentrale (freccia blu). |
Difetto arciforme
Il danno papillare glaucomatoso si localizza tipicamente al polo superiore o
inferiore. Le fibre nervose retiniche, che si originano dalla retina
periferica, si dirigono con un percorso arcuato verso la papilla: pertanto
un danno di uno dei poli (Fig. 1- parte A) creerà un disturbo delle
funzioni visive lungo il percorso curvilineo delle fibre nervose che entrano
nella papilla da uno dei due poli. Ciò comporta l'instaurarsi di un difetto
arciforme (Fig. 1- parte B e Fig. 2). I difetti hanno la stessa
caratteristica forma quale che sia lo strumento con il quale vengono
rilevati (schermo di Bjerrum, perimetro di Goldmann o perimetro
automatizzato); la differenza è che le moderne tecniche perimetriche, per
esempio la strategia d'esame SITA del perimetro Humphrey (5), sono in grado
di svelare la presenza di un difetto ad uno stadio molto più precoce di
quanto era possibile prima.
 |
|
Fig. 2 |
Salto nasale
Evidenziare un salto nasale fa pesantemente sospettare un glaucoma o
un'altra disfunzione papillare. Il fascio arcuato di fibre nervose
temporalmente alla macula non oltrepassa il meridiano o rafe orizzontale, e
pertanto se esiste un danno asimmetrico al polo superiore ed inferiore,
verosimilmente vi sarà anche un'asimmetria a livello del rafe. Questa
provoca l'instaurarsi di un deficit campimetrico a bordo netto lungo il
meridiano orizzontale (Fig. 3). Anche questo tipo di difetto è rilevabile
con diverse tecniche d'esame, ma con i moderni sistemi perimetrici la sua
evidenziazione è più facile e precoce.
 |
|
Fig. 3 |
Difetto paracentrale
Fibre nervose situate nelle porzioni periferiche del nervo ottico, vicino
alla guaina, hanno la loro proiezione retinica più perifericamente rispetto
alle fibre più centrali (Fig. 1 - parte C). Pertanto, un danno localizzato
vicino al bordo della papilla comporta l'instaurarsi di un difetto
periferico, spesso un salto nasale. Un danno localizzato a metà strada tra
l'escavazione e la sclera, d'altro canto, comporterà tipicamente
l'insorgenza di un difetto focale paracentrale (Fig. 4).
 |
|
Fig. 4 |
Perdite diffuse del campo visivo
Quando l'intero campo visivo presenta una riduzione uniforme della soglia di
sensibilità, si parla di perdite diffuse di campo visivo. Questo tipo di
difetto non è in relazione con un glaucoma, ma di solito è legato alla
presenza di una cataratta oppure ad una terapia con miotici (6).
La presenza combinata in molti occhi sia di cataratta o di terapia miotica,
sia di glaucoma o di ipertensione oculare, può essere la spiegazione del
falso convincimento, ormai superato, che una perdita diffusa del campo
visivo fosse dovuta a un glaucoma.
Aumento nelle fluttuazioni della sensibilità locale
Per un certo lasso di tempo, prima che si sviluppi nel campo visivo un
difetto costante di tipo glaucomatoso, si rilevano difetti transitori
localizzati sempre nella stessa area. Non è ancora stata chiarita l'esatta
eziopatogenesi per queste fluttuazioni focali sul lungo periodo. Tuttavia il
fatto che un difetto del campo visivo sia presente ad un primo controllo,
scompaia al controllo successivo e riappaia poi di nuovo, deve far sorgere
il sospetto di un difetto di tipo glaucomatoso precoce, in fase di
costituzione.
Difetti precoci del Campo visivo
La valutazione del campo visivo è, quindi, un esame fondamentale nel glaucoma. È attualmente la tecnica a cui viene riconosciuta maggiore importanza per stabilire la diagnosi e per controllare l'andamento nel tempo dei pazienti affetti da glaucoma primario ad angolo aperto. Sono disponibili svariati tipi di strumenti e di programmi e questo solleva alcuni interrogativi: dobbiamo preferire apparati che impiegano metodi cinetici o statici, dobbiamo privilegiare esami di screening o determinazioni di soglia? La risposta è in realtà estremamente lineare: il modo migliore di evidenziare le più precoci alterazioni nel glaucoma è di praticare una valutazione di soglia dei 30 gradi centrali del campo visivo mediante perimetria statica. Esami di screening evidenzierebbero solo scotomi più profondi di 6 decibel e la classica perimetria cinetica di Goldmann non sarebbe in grado di evidenziare perdite diffuse o piccoli scotomi. Inoltre, la perimetria automatica consente di memorizzare l'esame, per comparare mediante analisi statistica i risultati del singolo paziente con quelli di soggetti normali della stessa età e di monitorare le variazioni nel tempo per ogni paziente. In pratica i programmi 24-2 o 30-2 dell'Humphrey Field Analyser o i programmi G1 o G2 del perimetro Octopus sono quelli usualmente impiegati. Risultati perimetrici anormali sarebbero da comparare con quelli che ci si aspetta di trovare in caso di glaucoma, per valutare la significatività del difetto. I difetti iniziali sono tipicamente di due tipi: difetti fascicolari e depressioni generalizzate del campo visivo.
1) Difetti fascicolari
La natura dei difetti fascicolari è da porsi in relazione con la topografia
delle fibre del nervo ottico a livello della papilla. Reperti comuni nei
glaucomi iniziali sono:
a) "Salto" nasale: il c.d. salto nasale (una scalinatura
dell'isoptera ) viene spesso localizzato tra i 20° e i
30° dal punto di fissazione e può estendersi ulteriormente in periferia.
Se nei 30° centrali è presente un salto nasale, sia di tipo assoluto che
relativo, vale la pena di controllare la visione periferica, in modo da
definire l'estensione dello scotoma. Nel 5% dei casi, infatti, il salto
nasale è presente perifericamente ai limiti esterni dell'isoptera dei 30°,
e pertanto non viene evidenziato con la perimetria centrale convenzionale.
 |
|
Fig. 1 |
b) Deformazioni della macchia cieca: ingrandimenti omogenei della macchia cieca, relativamente comuni in pazienti miopi o anziani, non sono un sintomo di glaucoma iniziale. Tuttavia, in caso di glaucoma si può osservare una deformazione verticale della macchia cieca (fig. 2) che di solito configura un difetto arcuato iniziale ad andamento leggermente curvilineo; viene chiamato scotoma di Seidel.
 |
|
Fig. 2 |
c) Scotoma paracentrale: gli scotomi focali paracentrali vengono di solito evidenziati all'interno dei 20° centrali. In caso di depressione paracentrale poco profonda, il modo di progressione tipico è un approfondimento e un allargamento. Se questi scotomi hanno una dimensione inferiore a 6°, possono non essere evidenziati dalla perimetria, in quanto col programma 30-2 gli stimoli vengono presentati nell'area centrale ogni 6° e un poco più ravvicinati con il programma G1. In caso di scotoma paracentrale vicino al punto di fissazione (fig. 3) è consigliabile misurare la soglia foveale, per evidenziare un possibile difetto centrale.
 |
|
Fig. 3 |
d) Difetti arciformi: un difetto di forma arcuata, o scotoma di Bjerrum, è un segno attendibile di perdita glaucomatosa del campo visivo (fig. 4). Prende l'aspetto di uno scotoma che circonda il punto di fissazione. La sua estremità nasale può arrivare entro i 10° dal punto di fissazione o situarsi più lontano. Molti difetti arciformi sono collegati con la macchia cieca, mentre altri rimangono separati da essa. In molti casi, scotomi di vario tipo osservati inizialmente (salto nasale, scotoma paracentrale; (fig. 5) si allargano successivamente e formano un difetto arciforme riempiendo l'intera area arcuata che va dalla macchia cieca al rafe mediano.
 |
 |
|
Fig. 4 |
Fig. 5 |
e) Difetti periferici iniziali: difficilmente i difetti iniziali appaiono al di fuori dei 30° centrali. In tale caso, questi scotomi configurano o un salto nasale, o un salto verticale, oppure un difetto temporale a settore. Con la perimetria automatizzata è prassi comune misurare solamente il campo visivo centrale, ignorando pertanto la periferia. A seconda del metodo d'esame, quando si esplora l'intero campo visivo è presente una alterazione del campo visivo periferico senza modifiche nei 30° centrali dal 3 al 10% dei pazienti. In caso di glaucoma moderato o grave, una alterazione periferica è molto più frequente.
2) Depressione diffusa del campo visivo
Una depressione generalizzata del campo visivo è in molti casi una diretta
conseguenza di una pressione intraoculare eccessiva. Con la perimetria
automatizzata, un difetto diffuso si caratterizza per un MD (Difetto Medio o
Deviazione Media) alterato e una PSD (Pattern Standard Deviation, nel
perimetro Humphrey) o LV (Varianza della perdita, nel perimetro Octopus) che
rimangono entro limiti normali (fig. 6). Con la perimetria cinetica di
Goldmann, una perdita diffusa si traduce in un restringimento concentrico
generalizzato della macchia cieca. Queste alterazioni diffuse scompaiono con
la riduzione medica o chirurgica della pressione intraoculare. Una
depressione diffusa è considerata come un segno iniziale di glaucoma.
Tuttavia questo segno è aspecifico, perché presente in molte patologie
caratterizzate da un'opacità dei mezzi diottrici.
 |
|
Fig. 6 |
Conclusioni
Negli ultimi quindici anni, la perimetria automatizzata ha cambiato il
nostro modo di valutare le alterazioni iniziali della funzione visiva nel
glaucoma. Ad esempio, nel passato il glaucoma era considerato come una
malattia che interessava inizialmente la periferia. Oggigiorno, l'accurata
analisi statica delle isoptere centrali dimostra che i primi difetti sono in
molti casi localizzati entro l'area centrale. Impiegando altre tecniche di
valutazione visiva, come la sensibilità al contrasto o la percezione dei
colori, sembrerebbe anche che la visione maculare e foveale sia interessata
nelle prime fasi della malattia. Un paragone tra l'analisi istologica delle
fibre nervose ed i risultati perimetrici dimostra che si possono perdere
fino al 40% delle fibre, prima di evidenziare una alterazione mediante la
perimetria di Goldmann. La perimetria automatica consente una migliore
sensibilità, in quanto si osservano alterazioni già con una perdita del
10-15% di cellule ganglionari. Tuttavia, soprattutto in soggetti giovani con
ipertensione oculare marcata, le alterazioni del campo visivo possono essere
ritardate, per merito della grande plasticità del sistema visivo. In questi
casi, nel valutare la gravità del glaucoma l'analisi morfologica della
papilla potrebbe rivelarsi più efficace.
Apprendimento
Una certa quota di pazienti, modesta ma non trascurabile, necessita di un
adeguato addestramento, prima di essere in grado di praticare correttamente
esami del campo visivo. Di solito, in questi casi il primo campo visivo
eseguito presenta una netta depressione della sensibilità sulla media
periferia; per contro la mancanza di esperienza al perimetro non influisce
sulle depressioni nelle aree centrali. Pertanto, un difetto periferico in
una persona non abituata al test dovrebbe essere considerato con qualche
scetticismo e, prima di prendere una decisione diagnostica, è opportuno
ripetere il test. Invece, un difetto centrale, anche se riscontrato al primo
test, verosimilmente è correlato con una vera alterazione patologica.
Interpretazione del campo visivo mediante programmi computerizzati
Si è cercato in molti modi di interpretare il campo visivo mediante
programmi computerizzati. Alcuni indici del campo visivo, come la deviazione
media o la "pattern deviazione standard" (deviazione standard da
una modalità di comportamento normale) introdotti negli anni '80,
oggigiorno non hanno spazio nella diagnosi di glaucoma. Per tale diagnosi si
dovrebbe fare assegnamento su criteri interpretativi quali:
1. tener conto della variabilità fisiologica. Ciò può essere ottenuto
usando mappe di probabilità;
2. ignorare perdite diffuse del campo visivo. Si arriva a tale risultato
usando mappe di probabilità di deviazione da modello normale, al posto di
mappe di probabilità di deviazione globale. Nelle mappe di deviazione da
modello normale le depressioni omogenee sono rimosse matematicamente,
ottenendo così il risultato di evidenziare i difetti localizzati in un modo
abbastanza simile a quello col quale gli scotomi o le depressioni vengono
riprodotte dalle isoptere di una perimetria manuale di Goldmann;
3. prendere in attenta considerazione la forma del deficit del campo visivo.
Il Glaucoma Hemifield Test (7) (test dei semicampi visivi per il glaucoma);
(Fig. 2 - Fig. 3 - Fig. 4) del programma Humphrey Statpack II, è un esempio
di questo tipo di analisi. Il Glaucoma Hemifield Test paragona i dati dell'emicampo
visivo superiore con quelli corrispondenti dell'emicampo inferiore. Questo
tipo di paragoni è fatto in settori scelti, tenendo conto della normale
anatomia dello strato delle fibre nervose retiniche. Strumenti
interpretativi che non sono in grado di tenere in considerazione la
relazione spaziale, quali le curve di difetto cumulativo, sono spesso
fuorvianti e non dovrebbero essere usati.
Il sistema più largamente accettato di interpretazione computerizzata del
campo visivo nel glaucoma è il Glaucoma Hemifield Test; oltre a diversi
altri studi, esso è usato come criterio di inclusione per l'Early Manifest
Glaucoma Trial (EMGT).
Riassunto
L'individuazione di un glaucoma sulla base di alterazioni del campo visivo
dovrebbe richiedere un difetto campimetrico riproducibile, la cui forma
corrisponda al decorso anatomico delle fibre nervose retiniche; inoltre il
difetto dovrebbe preferibilmente corrispondere ad alterazioni della papilla
ottica. La forma di tale difetto è meglio evidenziata da modalità di
presentazione che non tengano conto degli effetti di una cataratta o di una
terapia miotica ed evidenzino bene i difetti focali. Un attento paragone su
archivi di perimetrie definiti empiricamente come normali è di grande
importanza, specialmente per individuare i difetti glaucomatosi più
precoci.
Modificazioni morfologiche della papilla ottica

Una variazione nell'aspetto della papilla può essere la prima tappa nella diagnosi di un glaucoma ed è il reperto oftalmoscopico più importante quando si sospetti la malattia.
 |
|
Il glaucoma è stato tradizionalmente definito con la
triade: aumento della pressione intraoculare (PIO), alterazioni papillari e
deficit del campo visivo. Più recentemente, studi istologici hanno
evidenziato che ci può essere una significativa perdita delle cellule
ganglionari retiniche e delle fibre del nervo ottico prima che, con le
tecniche convenzionali di esame del campo visivo, si evidenzi un deficit
funzionale. Altre ricerche hanno rivelato che, benché l'aumento della
pressione intraoculare sia uno dei principali fattori di rischio per una
neuropatia ottica glaucomatosa, essa non è necessariamente elevata in tutti
gli occhi che presentano questa alterazione patologica. Per contro, alcuni
soggetti possono tollerare una PIO più elevata prima che si determini una
perdita glaucomatosa di fibre nervose. Pertanto, la presenza di un ipertono
oculare di per sé non è sufficiente a porre la diagnosi di glaucoma. Tutti
questi dati possono condurre a dare una nuova definizione di glaucoma,
fondata sul reperto morfologico e/o psicofisico di una lesione glaucomatosa
del nervo ottico, indipendentemente dalla PIO rilevata.
Poiché una PIO elevata è il principale fattore di rischio, e dato che essa
può essere facilmente misurata, la tonometria continua ad essere uno dei
pilastri fondamentali nella diagnosi di glaucoma. Una pressione oculare più
elevata della norma, in un soggetto con campo visivo normale, è definita
come ipertensione oculare. Alcuni soggetti con ipertono oculare evidenziano
sintomi di una neuropatia ottica glaucomatosa clinicamente evidente,
nonostante la perimetria computerizzata acromatica convenzionale risulti
normale. Un'accurata identificazione di questi soggetti è di fondamentale
importanza in quanto previene un trattamento non necessario per quei
soggetti che non sono a rischio di glaucoma, mentre consente un trattamento
precoce dei pazienti glaucomatosi prima che il campo visivo si deteriori.
Per questa ragione, l'attenzione degli studiosi si è focalizzata su
tecniche alternative e più sensibili, per evidenziare le alterazioni
glaucomatose del nervo ottico più precocemente di quanto sia possibile con
la perimetria convenzionale. In diversi studi, su occhi con PIO elevata e
campo visivo normale, sono stati riferiti risultati anormali con alcune
tecniche di esame psicofisiche ed elettrofisiologiche, quali l'ERG a
stimolazione pattern, i test che misurano la sensibilità alla visione dei
colori e ai test di sensibilità a luce flicker e oscillante. Più
recentemente, la perimetria blu-giallo ha mostrato notevoli capacità nel
rilevare alterazioni glaucomatose del nervo ottico in soggetti ipertesi
oculari, che avevano dato risposte normali alla perimetria convenzionale
"bianco su bianco".
In funzione dell'esperienza dell'esaminatore e del "livello di
guardia" oltre al quale egli pone la diagnosi di glaucoma, la più
importante strategia diagnostica, tuttavia, potrebbe essere l'esame
morfologico della papilla (Fig. 1 - Fig. 2 - Fig. 3 - Fig. 4 - Fig. 5a -
Fig. 5b). Esso può essere condotto mediante un'oftalmoscopia di routine,
senza la necessità di altre tecniche sofisticate o costose. Inoltre può
fornire elementi sul tipo di glaucoma in atto, dato che svariati glaucomi
quali quello focale a pressione normale, il glaucoma atrofico primario ad
angolo aperto correlato all'età, il glaucoma primario ad angolo aperto
nella miopia elevata ed il glaucoma primario ad angolo aperto ad inizio in
età giovanile, presentano aspetti diversi della papilla ottica.
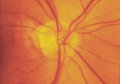
La valutazione della papilla ottica deve comprendere:
1. rilievo della dimensione e della forma papillare;
2. dimensione e forma del bordo neuroretinico, che è l'equivalente
intrapapillare delle fibre del nervo ottico;
3. dimensioni dell'escavazione papillare, rapportata all'estensione della
superficie papillare;
4. aspetto e profondità dell'escavazione;
5. posizione dell'emergenza dell'albero vascolare retinico sulla superficie
della lamina cribrosa;
6. presenza e localizzazione di emorragie "a scheggia";
7. presenza, dimensione, morfologia e localizzazione di un'atrofia
corioretinica peripapillare;
8. presenza di una riduzione generalizzata e/o localizzata del diametro
delle arteriole retiniche;
9. possibilità di visualizzare lo strato delle fibre nervose retiniche.
 |
 |
 |
|
Fig. 1 |
Fig. 2 | Fig. 3 |
 |
 |
 |
|
Fig. 4 |
Fig. 5a | Fig. 5b |
Grandezza della papilla
La grandezza della papilla non è costante per tutti i soggetti, ma mostra
una variabilità inter-individuale di circa 1:7; il che significa che vi
sono occhi normali anche se hanno una papilla piuttosto piccola o, per
converso, molto grande. I soggetti di razza caucasica hanno una papilla
relativamente piccola, seguiti da messicani, asiatici e soggetti americani
di razza nera. Nel glaucoma la papilla ha dimensioni normali, fatta
eccezione nel caso del glaucoma primario ad angolo aperto nei soggetti con
miopia elevata, nei quali è presente una macro papilla secondaria (o
acquisita). La predisposizione al glaucoma probabilmente non è correlata
con la grandezza della papilla. Essa può essere determinata mediante
planimetria di una sua fotografia; oppure con oftalmoscopi confocali a
scansione laser (SLO); oppure ancora con una normale lampada a fessura nella
quale la lunghezza del fascio luminoso può essere regolata sul diametro
della papilla.
Considerato come un equivalente intrapapillare delle fibre nervose retiniche
e delle fibre del nervo ottico, il bordo neuroretinico è uno dei punti di
repere principali nella valutazione del nervo ottico. Nei soggetti normali
la grandezza del bordo della neuroretina non è costante
inter-individualmente, ma evidenzia una variabilità tra i soggetti molto
marcata, similmente a quanto avviene per la papilla e l'escavazione
papillare. Essa è in relazione con l'area papillare: quanto più grande è
la papilla, tanto più grande è il bordo.
Bordo neuroretinico
In soggetti normali, anche la grandezza del bordo retinico varia da persona
a persona ed è in relazione con la superficie papillare; quanto più estesa
è la papilla, tanto più grande è il bordo. In occhi normali il bordo
neuroretinico mostra una configurazione caratteristica, risultando
solitamente più ampio nella porzione inferiore della papilla, di dimensioni
progressivamente decrescenti nella porzione superiore, poi in quella nasale
e infine nella porzione temporale (regola dell'ISN'T) (gioco di parole
intraducibile, in quanto "ISN'T" in inglese significa "Non c'è",
sottintendendo che non c'è glaucoma quando è rispettato questo fisiologico
andamento del bordo, NdT).Questa morfologia peculiare del bordo è di
fondamentale importanza nella diagnosi di danno iniziale glaucomatoso del
nervo ottico.
Nel glaucoma si ha una riduzione della rima neuroretinica in tutti i
quadranti papillari, più marcatamente in alcuni settori in funzione dello
stadio della malattia. Questa perdita di neuroretina non è patognomonica di
una neuropatia ottica glaucomatosa, in quanto si reperisce anche in occhi
che abbiano sofferto di una neuropatia ottica ischemica anteriore da
arterite, e in taluni pazienti con tumori endocranici, intra o sopra sellari.
In occhi con danno glaucomatoso di modesta entità, la riduzione del bordo
si evidenzia soprattutto nelle porzioni infero e supero temporali della
papilla. In occhi con atrofia glaucomatosa un poco più evoluta, la porzione
papillare temporale orizzontale è quella che mostra una riduzione
relativamente più netta del bordo. In caso di glaucoma molto avanzato,
quello che resta del bordo è situato principalmente nella porzione
papillare nasale, con una porzione relativamente meno ridotta nella regione
nasale superiore che in quella nasale inferiore.
Questo ha come conseguenza che per una diagnosi precoce di glaucoma si
dovrebbero ricercare alterazioni di tipo glaucomatoso soprattutto nelle
porzioni papillari temporali, inferiore e superiore.
Escavazione papillare
Analogamente a quanto succede per la papilla e per il bordo neuroretinico,
anche l'escavazione papillare mostra un'alta variabilità inter-individuale.
In un occhio normale, le superfici papillari e dell'escavazione sono
correlate tra loro: quanto più grande è la papilla, tanto più grande è
l'escavazione. Nelle papille piccole, solitamente, non è presente
un'escavazione, mentre le papille grandi di solito hanno un'escavazione
molto ampia. Per porre una diagnosi di glaucoma su basi morfologiche, questo
dato caratteristico va tenuto presente. Se non si tiene presente che papille
piccole non hanno solitamente escavazione, un glaucoma allo stadio iniziale
o poco evoluto può erroneamente essere sottostimato in pazienti con papille
piccole e rapporto cup/disc (C/D) relativamente basso.
Gli occhi glaucomatosi con papilla piccola e quelli apparentemente normali
ma con escavazioni glaucomatose di piccole dimensioni, spesso mostrano
anormalità della regione peripapillare, quali una diminuzione di visibilità
dello strato delle fibre nervose retiniche, una riduzione del calibro delle
arteriole retiniche, a tipo diffuso o localizzato, ed un'atrofia
corioretinica peripapillare. Per contro, un'estesa escavazione in una
papilla di grandi dimensioni non dovrebbe portare alla diagnosi di glaucoma,
se le altre variabili da prendere in considerazione (principalmente
l'aspetto del bordo neuroretinico e la visibilità dello strato delle fibre
nervose retiniche) sono normali.
Poiché la papilla è ovalizzata in senso verticale e l'escavazione in senso
orizzontale, nei soggetti normali i rapporti C/D sono più elevati per i
diametri orizzontali che per quelli verticali. Negli occhi normali, solo
meno del 7% ha un rapporto C/D orizzontale più piccolo del verticale. Poiché
il rapporto C/D dipende dalla grandezza della papilla e dell'escavazione,
l'alta variabilità inter-individuale di ambedue i parametri, rende ragione
del perché in una popolazione normale il rapporto C/D può andare da 0.0
fino a 0.9. In conseguenza della correlazione tra superfici della papilla e
dell'escavazione, il rapporto è basso nelle papille di piccolo diametro e
alto in quelle di grande diametro. Un rapporto C/D insolitamente elevato,
pertanto, può essere fisiologico in occhi con papille grandi, mentre un
rapporto C/D nella media è raro in occhi normali ma con papille piccole.
 |
 |
|
Fig. 1 |
Fig. 2 |
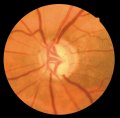
Emorragia a scheggia
Un'altra caratteristica dell'atrofia ottica glaucomatosa sono le emorragie a
forma di scheggia o a fiamma, localizzate sul bordo papillare. Difficili da
riscontrare in occhi normali, le emorragie papillari sono evidenziabili in
circa il 4-7% degli occhi glaucomatosi. La loro frequenza è massima nelle
fasi precoci del glaucoma. Nei glaucomi cronici semplici iniziali, esse si
localizzano solitamente nelle porzioni temporali inferiori o superiori della
papilla. Si riscontrano un poco meno spesso nel glaucoma secondario ad
angolo aperto, mentre sono un poco più frequenti nel tipo focale del
glaucoma a pressione normale.
Secondo le dimensioni iniziali, rimangono visibili, dopo la comparsa, per un
periodo variabile da 8 giorni a 12 settimane. Dopo un lasso di tempo
equivalente, spesso si evidenzia nello strato delle fibre nervose retiniche
un difetto localizzato, oppure l'ampliamento di un difetto localizzato
preesistente, oppure ancora un'incisura nel bordo neuroretinico a cui
corrisponde uno scotoma circoscritto del campo visivo. L'importanza
diagnostica delle emorragie papillari si fonda sulla loro elevata specificità,
in quanto in occhi normali si riscontrano solo raramente; pertanto esse di
solito segnalano la presenza di un danno glaucomatoso del nervo ottico,
anche se il campo visivo sembra apparentemente normale, oppure rivelano una
progressione della malattia glaucomatosa.
Atrofia peripapillare
L'atrofia corioretinica peripapillare sul contorno della papilla è stata
divisa in una zona beta centrale ed una zona alfa periferica. La zona
periferica (alfa) è caratterizzata da un'ipo e iperpigmentazione irregolare
e da un assottigliamento interno dello strato del tessuto corioretinico. Sul
suo lato esterno è confinante con la retina, e sul suo lato interno è in
contatto rispettivamente o con la zona beta o con l'anello sclerale
peripapillare. Caratteristiche della zona più interna (beta) sono una
marcata atrofia dell'epitelio pigmentato retinico e della coriocapillare,
una buona visibilità dei grandi vasi coroideali e della sclera, un
assottigliamento dei tessuti corioretinici e confini circolari con la zona
alfa adiacente. Essa è delimitata perifericamente dall'adiacente zona alfa
e centralmente dall'anello sclerale peripapillare. Quando entrambe le zone
siano presenti, la zona beta è sempre più vicino alla papilla che la zona
alfa. Ad un esame psicofisico, la zona beta corrisponde ad uno scotoma
assoluto e la zona alfa ad uno scotoma relativo.
In occhi normali le zone alfa e beta sono più grandi e frequenti nel
settore temporale orizzontale, seguito dall'area inferiore temporale e dalla
regione superiore temporale. Sono più piccole e rare nell'area
peripapillare nasale. Una zona alfa è presente in quasi tutti gli occhi
normali ed è quindi più comune di una zona beta (frequenza media in occhi
normali: circa 15%-20%). Le zone alfa e beta devono essere differenziate dal
crescente sclerale in occhi con miopia elevata alta e dal crescente sclerale
inferiore in occhi con disversione papillare. Taluni, ma non tutti gli occhi
con glaucoma, mostrano un'atrofia peripapillare anormalmente grande,
specialmente nella zona beta.
Ciò dipende dal tipo di glaucoma: l'atrofia peripapillare è più grande in
occhi con un glaucoma cronico semplice di tipo atrofico correlato all'età,
e più piccola in occhi con glaucoma cronico semplice di tipo giovanile e
nel glaucoma a pressione normale a tipo focale. L'ubicazione dell'atrofia
corioretinica peripapillare negli occhi con glaucoma è correlata
spazialmente con la perdita del bordo neuroretinico nella zona
intrapapillare. Dimensione, forma e frequenza di entrambe le zone non
differiscono tra occhi normali ed occhi con atrofia non glaucomatosa del
nervo ottico in modo significativo. Una valutazione dell'atrofia
peripapillare, pertanto, serve anche per differenziare una neuropatia ottica
glaucomatosa da un danno non glaucomatoso del nervo ottico.
Arteriole retiniche
Un restringimento diffuso delle arteriole della retina è evidenziabile in
occhi con svariati tipi di danno del nervo ottico, indipendentemente dalla
sua patogenesi. Il restringimento del vaso aumenta con il progredire della
neuropatia ottica. Oltre ad un restringimento diffuso delle arteriole
retiniche, nella regione peripapillare di occhi con glaucoma o neuropatia
ottica non glaucomatosa può essere riscontrato un restringimento focale
arteriolare. Questo significa che un restringimento localizzato del vaso non
è specifico per un glaucoma, e che esso quindi non riveste un ruolo
fondamentale e specifico nella patogenesi della malattia.
Strato delle fibre nervose retiniche
Lo strato delle fibre nervose retiniche contiene l'assone delle cellule
ganglionari della retina, coperto da astrociti e arrangiato in fasci dai
processi delle cellule di Muller. Poiché fa parte delle vie ottiche
afferenti, la sua valutazione è essenziale per la diagnosi di anomalie e
alterazioni patologiche del nervo ottico. Può essere valutato
oftalmoscopicamente o con fotografie grandangolari rosso-prive. Per la sua
valutazione oftalmoscopica è utile usare una luce verde. In occhi con mezzi
diottrici opachi, con una colorazione giallastra del cristallino oppure con
una scarsa pigmentazione dell'epitelio pigmentato retinico, lo strato delle
fibre nervose retiniche è meno visibile che in occhi con mezzi diottrici
limpidi e con un epitelio pigmentato retinico molto addensato. In aggiunta
all'accertamento della forma del bordo neuroretinico, la valutazione della
visibilità dello strato delle fibre nervose retiniche è della massima
importanza per una valutazione oftalmoscopica del nervo ottico.
In occhi normali, la visualizzazione dello strato delle fibre nervose
retiniche è distribuita sul fondo oculare in modo disuguale. Dividendo il
fundus in otto settori, i fasci delle fibre nervose sono meglio visibili nel
settore temporale inferiore, seguito dal temporale superiore, dal nasale
superiore e infine dal settore nasale inferiore. Sono invece meno visibili
nei settori superiore, inferiore, temporale orizzontale e nasale
orizzontale.
Di pari passo, il diametro delle arterie retiniche è significativamente
maggiore in corrispondenza del margine papillare temporale inferiore,
seguito dall'area temporale superiore, dall'area nasale superiore e da
ultimo dall'area nasale inferiore.
Ciò è in accordo con l'ubicazione della foveola sotto una linea
orizzontale passante per il centro della papilla, e con la configurazione
del bordo neuroretinico che è più largo al margine papillare temporale
inferiore, seguito dalla regione temporale superiore.
La visibilità dello strato delle fibre nervose retiniche diminuisce con
l'età, in relazione con una perdita di fibre del nervo ottico correlata
all'invecchiamento, ad un tasso annuale di riduzione di circa 4.000-5.000
fibre (rispetto ad una popolazione iniziale alla nascita di circa 1,4
milioni di fibre del nervo ottico).
In occhi glaucomatosi, la visibilità dello strato delle fibre nervose
retiniche è ridotta in funzione della perdita di fibre del nervo ottico. Le
alterazioni glaucomatose nello strato delle fibre nervose retiniche possono
essere divise in difetti localizzati o in una perdita diffusa.
I difetti localizzati sono definiti come cuneiformi e si dirigono verso la
papilla o arrivano in contatto con il suo margine. Se sono molto marcati,
possono avere una base larga sul rafe temporale del fundus, e sono presenti
tipicamente in circa il 20% o più di tutti gli occhi con glaucoma. Possono
però essere trovati anche in occhi con un'atrofia del nervo ottico dovuta
ad altre cause, ad esempio drusen della papilla, cicatrici corioretiniche da
toxoplasmosi, retinopatie ischemiche con essudati retinici cotonosi, dopo un
papilledema protratto nel tempo o dopo neuriti ottiche dovute a sclerosi
multipla. Dato che difetti localizzati dello strato delle fibre nervose
retiniche non sono presenti in occhi normali, quasi sempre essi significano
un'alterazione patologica. Va tenuto in considerazione, nondimeno, che non
sono patognomonici per un glaucoma, in quanto sono presenti anche in altri
tipi di atrofia del nervo ottico.
Oltre ai difetti localizzati, può verificarsi una perdita diffusa di fibre
nervose retiniche in occhi con un danno del nervo ottico glaucomatoso o non
glaucomatoso. Per evidenziare variazioni, è utile servirsi della cosiddetta
"sequenza dei settori del fundus riguardo alla migliore visibilità
dello strato delle fibre nervose retiniche". Se si scopre che in un
occhio, senza irregolarità del fundus, lo strato delle fibre nervose
retiniche è nettamente più visibile nel settore temporale superiore che in
quello temporale inferiore, ci si indirizza verso una perdita
prevalentemente nella regione del fundus temporale inferiore. E' anche utile
valutare se i vasi retinici sono chiaramente e nettamente definibili:
normalmente essi sono collocati nello strato delle fibre nervose retiniche.
In occhi con una perdita diffusa dello strato delle fibre nervose retiniche,
i vasi sono ricoperti solo dalla membrana limitante interna; questo
determina come conseguenza una visibilità migliore ed un'immagine più
nitida dei grandi vasi retinici.
Tenendo conto della facilità con cui si può procedere ad una valutazione
oftalmoscopica e della sua grande importanza nell'accertamento di anomalie e
malattie del nervo ottico, durante ogni oftalmoscopia di routine lo strato
delle fibre nervose retiniche dovrebbe essere accuratamente esaminato. Ciò
risulta vero specialmente per pazienti con un danno precoce del nervo
ottico. Questo dato è della massima importanza per la scoperta di un
glaucoma in occhi con una papilla piccola ed una piccola escavazione,
apparentemente normale ma in realtà glaucomatosa; ed è utile per
classificare come normale un occhio con una papilla grande e un'escavazione
marcata, apparentemente glaucomatosa ma in realtà normale. In occhi con
un'atrofia del nervo ottico già avanzata, altre tecniche d'esame, come la
perimetria, possono essere più utili per il follow-up del danno al nervo
ottico.
Riassumendo le linee guida per l'accertamento della morfologia della testa
del nervo ottico, le variabili più utili per indicare un danno glaucomatoso
del nervo ottico sono una forma anormale del bordo neuroretinico papillare
ed una ridotta visibilità dello strato delle fibre del nervo. Le variabili
più specifiche sono la presenza di un difetto circoscritto dello strato
delle fibre nervose retiniche e la comparsa di emorragie papillari a forma
di scheggia.
Queste anormalità morfologiche spesso precedono le alterazioni psicofisiche
o elettrofisiologiche, particolarmente la perimetria convenzionale con
stimolo bianco-su-bianco. Poiché esse possono essere valutate con facilità
semplicemente utilizzando un oftalmoscopio, la valutazione morfologica della
testa del nervo ottico è la tecnica diagnostica di scelta per scoprire fin
dalle prime fasi un danno glaucomatoso del nervo ottico in soggetti con
ipertono oculare ed in malati con glaucoma a pressione normale in "fase
pre-perimetrica". Studi ulteriori potranno mostrare, in futuro, se
tecniche più recenti come la perimetria a stimolo blu-giallo e la
perimetria con stimolazione flicker possono evidenziare più precocemente,
rispetto all'esame morfologico della papilla, un danno del nervo ottico.
Esame dello strato delle fibre nervose retiniche

Il glaucoma è una malattia ad eziologia multifattoriale
che provoca un danno degli assoni delle cellule ganglionari nel fondo
dell'occhio. La perdita delle fibre nervose conferisce un aspetto
glaucomatoso tipico alla papilla ottica. Oltre alla papilla ottica, si può
osservare un'atrofia degli assoni delle cellule ganglionari anche nello
strato di fibre nervose retiniche (RNFL). In effetti, un difetto del RNFL può
essere il segno più precoce di glaucoma che precede le alterazioni della
configurazione della papilla ottica e del campo visivo. Quindi un aspetto
normale della papilla e un campo visivo normale non devono necessariamente
far escludere un glaucoma.
Anormalità dello strato di fibre nervose retiniche in pazienti affetti da
glaucoma sono state riferite per la prima volta da Hoyt et al. nel 1973. Le
prime alterazioni osservabili riscontrate da questo autore erano difetti
sottili, simili ad una fessura, o solchi nell'area arcuata del RNFL. In casi
più avanzati si sono sviluppati difetti localizzati cuneiformi.
Il RNFL sano appare sotto forma di striature orientate regolarmente (Fig.
1), che sono formate da fasci di assoni, compartimentalizzati a tunnel,
formati dai processi delle cellule di Müller. Queste striature si osservano
perché la luce è riflessa dai fasci nervosi e dai setti gliali di
separazione. Esse vengono riconosciute più facilmente nella regione
peripapillare e nell'area delle fibre arcuate al di sopra e al di sotto
della macula. In queste aree vi sono numerosi fasci di fibre nervose per
ogni striscia e lo strato delle fibre nervose è più denso. Le fibre
nervose sono più difficili da visualizzare nel sottile rafe temporale e
nell'area nasale in cui le striature sono costituite da un fascio di fibre
per ogni striscia. Il RNFL è di maggior spessore nell'area peripapillare,
in particolare nel segmento temporale superiore o inferiore, dove può
raggiungere lo spessore di 300 µm (Quigley e Addicks, 1982). Le fibre
nervose originano dalle cellule della retina periferica, curvano attorno
alla macula e convergono nel canale coriosclerale che costituisce la maggior
parte del tessuto della papilla ottica.
L'organizzazione retinica delle fibre nervose è probabilmente tale che le
fibre che originano in sede più periferica sono situate in profondità
nella retina, più vicino all'epitelio pigmentato. Le fibre che originano più
prossimalmente si trovano più superficialmente nella retina, più vicino al
corpo vitreo. Nella papilla ottica i fasci di fibre nervose superficiali
sono situati centralmente, mentre le fibre che hanno origine più
perifericamente sono situate più vicino al margine del canale coriosclerale.
Infatti questa organizzazione dei fasci di fibre determina la sede e la
forma del campo visivo glaucomatoso.
In un esame clinico di routine è possibile osservare il RNFL con luce verde
alla lampada a fessura con una lente di Volk o una lente a contatto di
Goldmann. I fasci di fibre nervose possono essere seguiti fino al livello
della macula. È utile regolare la fessura più grande e piatta, quasi
quadrata, per poter vedere aree più grandi in una sola volta. L'aspetto
opaco, leggermente argenteo, dei fasci di fibre nervose, è facilmente
riconoscibile. Con un oftalmoscopio si può seguire l'andamento a striscia
per circa un diametro di distanza dalla papilla ottica. E' utile dapprima
valutare il nervo ottico e poi vedere se l'aspetto del RNFL confermi i
reperti della papilla ottica. D'altra parte può darsi che un difetto
cuneiforme localizzato nel RNFL richiami l'attenzione verso una sede
specifica sulla papilla, aiutando così a riconoscerne le alterazioni
iniziali.
Il glaucoma può provocare un danno localizzato (Fig. 2) o diffuso (Fig.
3) del RNFL o un insieme di entrambi. I problemi nella valutazione dello
strato di fibre nervose spesso riguardano una sovrastima dei difetti locali
e una sottostima della perdita di fibre nervosa diffusa. Nel 50% degli occhi
che sviluppano un glaucoma, la prima anormalità riconoscibile del RNFL è
rappresentata da una perdita diffusa di assoni, in altre parole, un
assottigliamento generalizzato del RNFL. Nelle fasi iniziali ciò non è
sempre facile da riconoscere, fino a quando non è associato ad un
ingrandimento generalizzato dell'escavazione papillare (Tuulonen e
Airaksinen, 1990). I difetti cuneiformi localizzati del RNFL (Fig. 2)
sono riconosciuti assai più facilmente. La punta più ristretta del cuneo
si trova più spesso al margine papillare o nell'area peripapillare in sede
temporale superiore o inferiore.
Nel corso degli anni è apparso evidente che, in molti casi, le anormalità
del RNFL sono i primi segni riconoscibili del glaucoma iniziale. Quindi
abbiamo eseguito un progetto di screening della popolazione con una macchina
fotografica per il fondo, con obiettivo grandangolare, all'infrarosso. Con
questa macchina fotografica si può osservare su uno schermo televisivo il
fondo degli occhi del paziente con illuminazione infrarossa ed effettuare
una fotografia con un flash normale. Questa tecnica è abbastanza rapida e
sicura, poiché non è necessario dilatare la pupilla.
In una popolazione di parenti di I grado sani di pazienti affetti
notoriamente da glaucoma, la qualità dell'immagine era buona od ottima nel
90% dei casi e scarsa o scadente, ma valutabile, nel 5% dei casi. I pazienti
con reperti della papilla ottica e del RNFL anormali o sospetti sono stati
inviati a consulto nella Clinica Oculistica dell'Università per un esame
oculare completo. In 6 dei 31 casi inviati a consulto con anormalità del
RNFL si sono riscontrati i classici segni di glaucoma, con piccole anormalità
del campo visivo. Nove pazienti hanno presentato solo tipiche anormalità
del RNFL con aspetto normale della papilla e campo visivo normale. Sembra
che lo screening della popolazione con questa tecnica permetta un risparmio
di tempo e di costo.
Anche se l'analisi del RNFL richiede un certo tempo per essere appresa, essa
fornirà molte informazioni supplementari al medico da associare alla
valutazione della papilla e campo visivo. Tuttavia uno degli inconvenienti
è che la valutazione del RNFL è soggettiva e qualitativa, ma ciò,
ovviamente, vale anche per la valutazione della sola papilla. Di recente
sono state messe a punto tecniche promettenti, mediante una tecnologia di
alto livello, per quantificare le anormalità del RNFL misurando lo spessore
o il contorno del RNFL. Tale apparecchiatura, che utilizza un raggio laser a
scansione coerente, ha il vantaggio di essere relativamente insensibile a
pupille piccole e alla presenza di una cataratta. Quando sarà a
disposizione del medico, questa tecnica potrà migliorare notevolmente la
diagnosi e il controllo a distanza del glaucoma.
 |
 |
 |
|
Fig. 1 |
Fig. 2 | Fig. 3 |

Il rinnovato interesse, dimostrato negli ultimi anni
dagli studiosi per gli esami elettrofisiologici nel glaucoma, è legato al
miglioramento delle tecniche e alla necessità di trovare indicatori
possibilmente obiettivi in grado di mettere in evidenza le ipertensioni
endoculari a rischio.
Infatti, le tecniche elettrofisiologiche, similmente a quelle psicofisiche,
non sono invasive. Al contrario delle tecniche psicofisiche, prescindono
dalla necessità di particolari comportamenti da parte del soggetto in esame
e soprattutto dal cosidetto "learning effect", così importante
per rendere attendibile un esame psicofisico.
Le passate esperienze basate sullo studio delle ampiezze e latenze dell'elettroretinogramma
a flash (ERG), avevano dato risultati del tutto deludenti.
Anche gli studi sulla funzione del nervo ottico nel glaucoma precoce, basati
sui potenziali visivi evocati (PEV) con stimolo pattern non
avevano portato a nuove conoscenze cliniche, perché le modifiche dei PEV
sembravano correlate molto più ad alterazioni dei mezzi diottrici e alle
classi d'età, che non ad un iniziale danno glaucomatoso. Questo fatto è
perfettamente logico perché i PEV, riflettendo essenzialmente la funzione
maculare, sono alterati principalmente nei disturbi del campo visivo
centrale.
Recentemente si sono registrati progressi sia nel campo dell'ERG con lo
studio delle soglie scotopiche che sono precocemente alterate
nell'ipertensione endoculare, sia in quello del PEV pattern con
l'utilizzazione di uno stimolo cromatico di barre blu e nere in un campo di
adattamento giallo. E' noto infatti che le prime alterazioni del senso
cromatico nel glaucoma precoce interessano essenzialmente l'asse tritan.
Il valore clinico di queste tecniche deve essere ancora valutato. Infatti la
registrazione delle soglie scotopiche presenta il problema dei lunghi tempi
di addattamento e degli ammiccamenti, mentre l'acquisizione del PEV pattern
con stimolo cromatico blu-giallo deve tener conto di possibili artefatti
legati a difetti di trasparenza del cristallino. Fra le varie tecniche
elettrofisiologiche, quella che ha destato il maggior interesse per la
relativa semplicità e la costanza dei risultati ottenuti, è costituita
dall'elettroretinografia con stimolo pattern (PERG). Il
razionale dell'utilizzazione dei PERG nello studio del glaucoma, si basa
sugli studi di Maffei e Fiorentini (1981) che suggerirono l'ipotesi che
questi potenziali traessero origine dalle cellule ganglionari della retina e
potessero quindi rappresentare un indice molto precoce del danno di tali
strutture.
I PERG rappresentano una risposta elettrica retinica ad uno stimolo pattern
originata principalmente a livello delle cellule ganglionari. Con la
stimolazione "transient" sono costituiti da tre componenti: una N.
35, una P. 50 e una N. 95 (Fig. 1). Con la stimolazione "steady
state" si ottiene un'onda sinusoidale (Fig. 2a - Fig. 2b).
La latenza dei PERG è scarsamente influenzata dalle più svariate
condizioni patologiche, compreso il glaucoma, mentre un danno delle cellule
ganglionari si ripercuote pesantemente sulle ampiezze. Da questo punto di
vista, i PERG rappresentano quindi una metodica particolarmente adatta a
monitorare il danno glaucomatoso iniziale.
La tecnica di registrazione dei PERG è relativamente semplice e alla
portata di qualsiasi laboratorio che disponga di un apparecchio di nuova
generazione. Va tuttavia rilevato che la sensibilità della metodica è
strettamente legata al rispetto di alcuni parametri di stimolazione:
 |
 |
 |
|
Fig. 1 |
Fig. 2a | Fig. 2b |
Definizione
Introduzione
Manifestazioni oculari
Vi sono tuttavia numerose differenze sistemiche. Questa condizione morbosa colpisce le donne con frequenza doppia rispetto agli uomini. I pazienti affetti possono evidenziare una probabilità superiore alla media di essere affetti da vasospasmi periferici, come fenomeni di Raynaud o emicrania. In una certa percentuale di GTN non è raro evidenziare patologie autoimmuni.
Diagnosi Differenziale
Può essere divisa come segue:
a) Neuropatia ottica non glaucomatosa.
La PIO, il campo visivo e l'età dei pazienti è paragonabile a quella dei
pazienti glaucomatosi. La papilla non evidenzia escavazioni glaucomatose, ma
piuttosto un'atrofia ottica piatta, con l'area di atrofia che è più estesa
rispetto all'estensione del difetto del campo visivo (disparità papilla -
campo visivo). Quando si verifica un'estesa perdita neuronale, la papilla può
andare incontro ad un marcato aumento dell'escavazione centrale, con aspetto
pallido della restante rima. La situazione clinica non mostra progressioni.
b) Glaucoma cronico ad angolo aperto con pressione
elevata e saltuari episodi di pressione "normale".
Un concetto più teorico con ampie fluttuazioni diurne che
"nascondono" un danno che induce una PIO elevata.
c) Glaucoma ad Angolo Aperto di tipo Secondario, con una
PIO usualmente normale dopo un'iniziale episodio di ipertensione
sufficiente per produrre un'escavazione glaucomatosa (per esempio un
glaucoma da cortisone, un'uveite ipertensiva).
Ogni paziente giovane con glaucoma ed un rilievo anamnestico di patologie
del segmento anteriore o di uso di lenti a contatto dovrebbe essere
accuratamente indagato per appurare se ha fatto uso topico di cortisone.
d) Altre lesioni che compromettono le vie di conduzione
della visione.
Lesioni del chiasma ottico e delle vie ottiche fino alla corteccia
occipitale producono difetti del campo visivo che non intaccano il meridiano
verticale. Col tempo esse provocano anche un'atrofia ottica senza
escavazione glaucomatosa.
Patogenesi
Sino ad oggi, la terapia più efficace è stata quella di abbassare la PIO.
In teoria, questo dovrebbe aumentare la pressione di perfusione e,
conseguentemente, la nutrizione della testa del nervo ottico. Questo
potrebbe essere di beneficio per i neuroni danneggiati, ritardando od
arrestando la progressione della malattia. Dopo chirurgia filtrante, sono
stati rilevati un aumento sia della velocità ematica nell'arteria oftalmica
sia della pulsazione oculare. Una diminuzione della PIO è a favore sia
dell'ipotesi vascolare, in quanto migliora l'apporto ematico al nervo
ottico, sia dell'ipotesi meccanica, che postula che la PIO possa essere
"troppo alta per quell'occhio", perché quel nervo ottico sarebbe
meno capace di "sopportare" anche una PIO compresa in valori
normali.
Secondo quest'ipotesi, il supporto meccanico fornito dalla lamina cribrosa
sarebbe insufficiente, in quanto sia la qualità (quindi il tipo) di
collagene sia la struttura anatomica (quindi la quantità) sarebbero
inadeguati. Da ultimo, e in linea speculativa, per adeguarsi all'ipotesi
meccanica, la lamina cribrosa potrebbe essere danneggiata da un abnorme
gradiente di pressione tra le sue facce; quindi, non tanto da una PIO troppo
alta, ma da una pressione endocranica più bassa del normale.
Indagini diagnostiche
a) Per confermare la diagnosi
b) Per identificare il fattore causale
c) Cercare ogni possibile lesione retrobulbare.
Se si evidenzia una qualche differenza tra la morfologia del nervo ottico ed
il tipo di difetto del campo visivo, sono necessari una tomografia cerebrale
ed altri esami neurologici. In presenza di un glaucoma, deve esistere una
stretta relazione tra escavazione papillare e difetto del campo visivo.
Un'atrofia più estesa rispetto alla perdita del campo visivo potrebbe
significare una precedente neuropatia ottica anteriore su base ischemica.
Difetti del campo visivo che non interessino il meridiano verticale, e
difetti centrali, piuttosto che paracentrali od arcuati, sono tutti sintomi
che implicano un accertamento neurologico approfondito.
Terapia
Un trattamento è indicato in caso di progressione della malattia. Sono
pochi i pazienti che divengono legalmente ciechi a causa di un GTN. Molti di
questi pazienti sono anziani al momento della diagnosi, ed hanno un ritmo di
progressione del difetto talmente lento che, anche senza trattamento, per il
resto della loro vita non lamenteranno una riduzione delle funzioni visive
significativa sotto il profilo clinico.
Una diminuzione significativa delle funzioni visive può determinare
limitazioni nella vita associativa, per esempio la revoca della patente di
guida. Un peggioramento può essere identificato mediante un'analisi di
cambiamento, usando software commercialmente disponibile (come lo Statpac 2)
o un'analisi del trend. Sia l'uno sia l'altro tipo di analisi dovrebbero
essere usate per identificare alterazioni localizzate, piuttosto che
diffuse. Prima di prendere qualsiasi decisione terapeutica, particolare
attenzione va posta nel differenziare le variazioni a lungo termine dai veri
e propri cambiamenti. I trattamenti attuali sono rivolti ad abbassare la
PIO, e/o a porre rimedio ad insufficienze reversibili nella circolazione del
nervo ottico.
a) Riduzione della PIO
Recenti ricerche hanno fatto supporre che la riduzione della PIO possa
esercitare un benefico effetto sul corso della malattia. Una riduzione del
25-30% dà la maggior probabilità di rallentare la progressione; questo può
essere ottenuto con una terapia medica. In caso di fallimento, si ricorre
alla chirurgia filtrante, potenziata nell'esperienza di chi scrive dall'uso
del 5 fluorouracile. Se la chirurgia non ottiene la predetta riduzione del
25-30%, può succedere che non si arrivi al rallentamento desiderato nella
progressione del peggioramento.
b) Riduzione delle alterazioni circolatorie della testa del nervo ottico.
Vasospasmo: una risposta anormale al freddo (vasocostrizione) della circolazione delle dita può essere un indice affidabile di vasospasmo. Questa tendenza può essere trattata con i bloccanti dei canali del Calcio, e con la reinspirazione di CO
2 (facendo respirareil paziente in un sacchetto di plastica, N.d.R.). Sotto il profilo teorico, anche gli inibitori dell'anidrasi carbonica possono esercitare un effetto favorevole. E' stato illazionato che si abbia un effetto terapeutico del Trusopt mediante questo meccanismo.
Ipotensione notturna ("calo pressorio"). Pazienti in terapia ipotensiva sistemica ed alcuni pazienti con GTN possono evidenziare una riduzione eccessiva della pressione sistolica e diastolica durante il sonno. Ciò, in assenza di una parallela riduzione della PIO, potrebbe ridurre la loro pressione di perfusione oculare. A tutti i pazienti con GTN dovrebbe essere chiesto se fanno uso di terapie ipotensive sistemiche; in caso affermativo, dovrebbero essere sottoposti ad accertamenti per evidenziare possibili cadute di pressione vascolare. Pazienti con pressione sistolica bassa e "cali" notturni di pressione potrebbero trarre beneficio da una dieta con eccesso di sale, e da un trattamento steroideo con mineralocorticoidi. Non si ha comunque, al momento attuale, una sicura dimostrazione di un effetto favorevole di questo tipo di trattamento.
Insufficienza carotidea: pazienti con un "glaucoma a tensione normale" asimmetrico possono evidenziare una significativa (>50%) riduzione del lume della carotide comune, con conseguente turbolenze di flusso e riduzione del volume di flusso. I rami terminali dell'arteria oftalmica (particolarmente quelli nella regione laminare del nervo ottico) soffrirebbero come risultato di una riduzione nel flusso di perfusione.
Allo stato delle nostre conoscenze, una riduzione della PIO di circa il 25%, l'abolizione di un vasospasmo e la correzione di un calo pressorio notturno indotto da terapia ipotensiva sistemica danno le migliori garanzie per quei pazienti che presentano un deterioramento progressivo delle funzioni visive.
Un foglio di carta potrebbe chiudere bruscamente il tubo di scarico di un serbatoio, bloccando il deflusso dell'acqua. Nell'occhio l'iride puo' agire come il foglio di carta e chiudere improvvisamente lo scarico dell'umore acqueo causando un rapido aumento della pressione intraoculare. Questo improvviso aumento pressorio, se non curato in tempo, puo' portare a cecita' in breve tempo. I sintomi principali sono l'offuscamento della vista, gli aloni attorno alle luci, il dolore oculare violento, la nausea e il vomito.
Questa forma di glaucoma colpisce occhi che sono predisposti a causa di una particolare conformazione. Si tratta di occhi piuttosto piccoli con camera anteriore di minor volume ed angolo camerulare stretto.
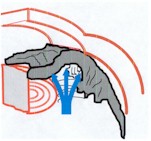 In
tali occhi l'angolo della camera anteriore per effetto di vari stimoli può
chiudersi impedendo la fuoriuscita dell'umore acqueo. Ne consegue un aumento
della pressione oculare più o meno violento.
In
tali occhi l'angolo della camera anteriore per effetto di vari stimoli può
chiudersi impedendo la fuoriuscita dell'umore acqueo. Ne consegue un aumento
della pressione oculare più o meno violento.
Anche questa forma di glaucoma é geneticamente determinata, ma si manifesta nella seconda metà della vita, con frequenza che aumenta con l'aumentare della età anagrafica.
La chiusura dell'angolo può avvenire in maniera graduale e progressiva ed in tal caso si verificherà un glaucoma ad andamento cronico non molto dissimile da quello che abbiamo descritto per il GPAA (Glaucoma Primario a Pressione Normale).
In alcuni casi invece si instaura all'improvviso una chiusura completa il ché determina un subitaneo ed estremo aumento della pressione oculare. Ne consegue il cosiddetto attacco di glaucoma acuto, una delle più drammatiche malattie oculari.
Sintomi di un attaco di Glaucoma Acuto
Solo se la terapia é tempestiva ed adeguata l'angolo della camera anteriore potrà riaprirsi in maniera più o meno completa e si potrà avere una guarigione con buon recupero. In caso contrario l'angolo rimarrà definitivamente chiuso, la pressione oculare si stabilizzerà su livelli elevati e la malattia diverrà cronica. In questo caso i danni anatomici e funzionali saranno rilevanti. Nei casi peggiori si può rapidamente arrivare alla cecità.
La terapia consiste in un primo momento soprattutto in provvedimenti farmacologici ed una iridotomia laser. In un secondo momento é tuttavia frequente la necessità di un intervento chirurgico.
Gli occhi predisposti al glaucoma da chiusura d'angolo sono facilmente riconoscibili ad una visita oculistica. Se necessario essi possono essere protetti mediante l'esecuzione di una iridotomie laser a scopo preventivo o mediante l'uso continuativo di adatti farmaci.
L'attacco di glaucoma acuto é il più spesso monolaterale, ma fatalmente prima o poi si ripeterà nel secondo occhio.
Per questa ragione l'occhio controlaterale deve comunque essere sottoposto ad una iridotomia preventiva.
In questa forma il sistema di drenaggio e' "costruito" male sin dalla nascita e cio' causa l'aumento della pressione intraoculare. Il bambino presenta fotofobia (fastidio alla luce) e lacrimazione. L'aumento della pressione endoculare puo' causare un aumento delle dimensioni dell'occhio (nel bambino le pareti oculari sono meno resistenti) e la cornea puo' divenire opaca. Ogni sintomo sospetto deve spingere i genitori dall'oculista per effettuare una visita di controllo. Questo tipo di glaucoma colpisce 1 neonato ogni 10.000.
É una forma molto rara di glaucoma che si manifesta il più spesso entro i primi due anni di età. Prende anche il nome di glaucoma malformativo o idroftalmo. Esistono anche forme fruste.
Questo tipo di glaucoma é dovuto anche ad una malformazione congenita dell'angolo camerulare che rende difficoltoso il deflusso dell'umore acqueo della Camera Anteriore dell'occhio. Ne risulta un aumento della pressione oculare il cui grado dipende dalla gravità della malformazione.
Nell'occhio del bambino, le cui pareti sono ancora deformabili, l'ipertensione oculare determina uno sfiancamento con aumento del volume del bulbo. Il nervo ottico subisce lo stesso tipo di lesione che si ha negli altri glaucomi ed inoltre la cornea tende a perdere la sua trasparenza.
Con l'andare del tempo il risultato, se non interviene l'adatta terapia,é fatalmente la cecità.
Questa malattia può essere tuttavia curata con interventi chirurgici particolari che sono diversi da quelli usati nei glaucomi dell'adulto.
Le probabilità di successo
É essenziale che vengano notati i primi segni della malattia che sono caratteristici: il bimbo é irrequieto, piange facilmente, é fortemente infastidito dalla luce, ha facile lacrimazione e tende a tenere gli occhi chiusi. Nei casi più gravi gli occhi sono più grandi del normale e la cornea é intorbidata.
Una volta sorto il sospetto il bambino deve essere avviato ad un centro specializzato dove attraverso una osservazione, che andrà necessariamente eseguita in narcosi, la diagnosi sarà facilmente confermata od esclusa.
La terapia di questa malattia é esclusivamente chirurgica.
Quando la diagnosi é posta in tempo e la terapia istituita senza ritardi molti di questi occhi possono andare incontro a guarigione.
Esistono numerose forme di glaucoma che non sono espressione di una malattia primitiva, ma rappresentano piuttosto la conseguenza di altre malattie oculari, di traumi o degli effetti indesiderati di alcuni farmaci.
In molti di questi casi l'angolo della camera anteriore e più in generale le vie di deflusso dell'umore acqueo vengono alterate da malattie infiammatorie, emorragie, tumori, spostamenti del cristallino, proliferazione di tessuti anomali ed altro.
L'evoluzione di questi glaucomi é talvolta di tipo cronico, ma incerti casi assume un andamento più violento, con dolore, arrossamento ed intorbidamento della visione.
La terapia dei glaucomi secondari varia grandemente a seconda delle malattie di base che li determinano. I risultati non sono sempre soddisfacenti.
Una forma particolare di glaucoma secondario che deve essere conosciuta é il glaucoma da cortisonici.
L'uso prolungato di questi farmaci, specialmente per via locale può indurre un glaucoma del tipo cronico con caratteri molto simili a quelli del GPAA (Glaucoma Primario ad Angolo Aperto), ma con andamento più grave. Per questa ragione l'uso di colliri contenenti cortisonici deve essere limitato ai casi di reale necessità e deve essere accompagnato da un accurato controllo oculistico.
in questa condizione l'ostacolo al deflusso e' secondario a certe malattie (fra cui il diabete), all'uso di alcuni farmaci, alle emorragie, ai tumori e a stati infiammatori.
La terapia medica del glaucoma ha lo scopo di arrestare o di prevenire l'atrofia del nervo ottico ed il parallelo deterioramento del campo visivo. Al momento attuale ciò può essere ottenuto, anche se non sempre, riducendo il valore della pressione oculare (P.O.) a valori "non dannosi" per l'occhio da trattare. Questi valori variano individualmente e sono condizionati da una serie di parametri che è necessario conoscere prima di iniziare il trattamento. Occorre quindi stabilire per ogni paziente una ben definita strategia individuale, espressione delle sue condizioni cliniche.
PRESSIONE OCULARE
Quando si decide di iniziare il trattamento occorre essere ragionevolmente
convinti che i valori pressori rilevati non sono tollerati dall'occhio in
esame e che quindi devono essere ridotti. L'esecuzione di una curva
pressoria pre-trattamento ci fornirà le indicazioni necessarie per
conoscere il valore pressorio medio, ma soprattutto i momenti della giornata
in cui compaiono pericolosi picchi pressori. I valori pressori rilevati
dovranno essere confrontati con il danno del disco ottico e del campo
visivo; se possibile anche con la presumibile durata dell'ipertono. Dalla
valutazione di tali parametri potrà essere stabilito un valore pressorio
soglia da raggiungere e mantenere durante tutta la giornata mediante la
terapia. E' intuitivo che tale valore-soglia varierà individualmente e che
non sarà corretto ritenere come "normali" per tutti, valori
inferiori ai 21 mmHg. Ricordiamoci che quasi il 30% dei glaucomi primari ad
angolo aperto presenta pressioni oculari pre-trattamento inferiori ai 21
mmHg. Inoltre è necessario indagare sulla presenza di altri fattori di
rischio (diabete, miopia, vasculopatie, etc.) che rendono il disco ottico più
vulnerabile anche all'azione di valori pressori ben tollerati da altri
soggetti. E' comunque consigliabile durante l'esecuzione della curva
pressoria pre-trattamento, misurare la pressione arteriosa sistemica (PAS)
ad ogni controllo pressorio oculare per conoscere oltre alla pressione
oculare anche la pressione di perfusione (PAS -P.O.), soprattutto in
pazienti affetti da ipertensione sistemica ed in trattamento con farmaci
antiipertensivi. In alcuni casi particolari di glaucoma a bassa pressione,
può risultare utile conoscere l'andamento della pressione arteriosa
sistemica anche durante le ore notturne specie se il soggetto assume prima
del sonno antiipertensivi e/o sonniferi. Aver raggiunto i valori pressori
oculari stabiliti per un dato soggetto non vuol dire essere certi che la
terapia adottata abbia raggiunto lo scopo: occorre sincerarsi che il
conseguimento di tali valori abbia arrestato l'evoluzione del danno. Per
conoscere tutto ciò è necessario disporre prima dell'inizio della terapia
di un accurato esame del disco ottico e del campo visivo.
DISCO OTTICO
L'esame del disco ottico richiede esperienza ed estrema diligenza in quanto
frequentemente i primi segni di sofferenza glaucomatosa sono aspecifici e di
dubbia interpretazione. L'esaminatore deve scegliere la metodica che
personalmente ritiene più attendibile per osservare e quindi documentare
obiettivamente le condizioni del disco ottico e delle fibre nervose
retiniche che lo costituiscono. Una fotografia del disco, specie se
stereoscopica, risulta comunque indispensabile; essa deve essere corredata
da un sintetico commento e, quando necessario, da un disegno che sintetizzi
le caratteristiche morfologiche che dovranno essere valutate nei successivi
controlli. Non tutti possono disporre di sofisticate e dispendiose
apparecchiature che forniscono i molti parametri che caratterizzano un disco
ottico e le fibre nervose retiniche. Non è il caso di ricordare l'utilità
e l'importanza di tali strumentazioni. Indubbiamente di fronte ad un
"iperteso oculare" (P.O. > 21 mmHg) senza apparente danno
papillare, un approfondito esame fotografico delle fibre nervose retiniche
è quanto mai auspicabile.
CAMPO VISIVO
Un esame perimetrico computerizzato di soglia, ripetuto due o tre volte
rappresenta quasi sempre un documento prezioso ed attendibile per
evidenziare e quantificare l'entità del danno glaucomatoso e per poterlo
seguire nel tempo. Esistono poi casi in cui le condizioni del disco ottico
sono tali da farci supporre anche la presenza di un danno funzionale, ma il
campo visivo sembra non riprodurre tale sofferenza. In tali circostanze
dovremo approfondire la nostra ricerca ricorrendo ad altre indagini più
selettive (high-pass resolution perimetry, blue-yellow perimetry, sensibilità
al contrasto, esami elettrofunzionali) che avranno come scopo non tanto
quello di evidenziare il danno quanto quello di quantificarlo per poterne
seguire l'evoluzione in corso di trattamento.
TRATTAMENTO FARMACOLOGICO
Attualmente disponiamo di numerosi farmaci ipotensivi oculari per cui la
scelta dovrà cadere su quella sostanza che più si addice al caso in esame.
Occorre iniziare il trattamento con il farmaco che consenta di raggiungere e
mantenere il valore pressorio soglia e che nel contempo risulti ben
tollerato dal paziente (età, lavoro del paziente, altre patologie oculari o
sistemiche, numero di somministrazioni necessarie).
I beta-bloccanti rappresentano da molti anni i farmaci di prima scelta nel
trattamento di varie forme di glaucoma, in quanto efficaci e ben tollerati.
Attualmente disponiamo anche di un inibitore topico dell'anidrasi carbonica
(Dorzolamide) e di un Prostaglandina-derivato (Latanoprost) che per
l'indubbia azione ipotensiva e per la buona tollerabilità, possono essere
considerati come farmaci di prima scelta specie quando i beta-bloccanti
trovano controindicazioni di carattere generale ( bradicardia, ipotensione
arteriosa, broncospasmo, etc.). Il trattamento deve iniziare con uno solo di
questi farmaci e con il dosaggio più basso (beta-bloccanti). Una curva
pressoria eseguita a distanza di alcuni giorni dall'inizio del trattamento
ci fornirà i primi risultati. Se il primo farmaco adottato non
"normalizza" la P.O. per l'intera giornata, dovrà essere
introdotto un altro farmaco tra quelli riportati, essendo la loro azione
molto spesso additiva.
Altre sostanze ad azione adrenergica (Dipivefrina, Apraclonidina,
Brimonidina), se ben tollerate dal paziente possono essere usate per
integrare la terapia già in uso anche se occorre conoscere bene l'effetto
di un'azione combinata di questi farmaci con i beta-bloccanti (midriasi da
beta-bloccante più Dipivefrina).
Farmaci molto efficaci, ma poco tollerati dal paziente, specie se giovane,
miope o affetto da cataratta incipiente sono i colinomimetici (miotici). La
loro somministrazione è tuttavia opportuna quando altri farmaci non sono
sufficientemente efficaci e necessaria quando è presente o temibile una
chiusura d'angolo (blocco pupillare, iride a plateau).
Quando si somministra un farmaco ad azione limitata nel tempo (4-6 ore) è
indispensabile instillarlo secondo quanto suggerito dalla curva pressoria
individuale cioè prima che si verifichino eventuali crisi ipertensive nel
corso della giornata.
|
|
Esistono numerosi medicamenti, in forma di collirio, che instillati negli occhi sono in grado di ridurre sensibilmente la pressione oculare. In caso di necessità essi possono anche essere associati in terapie che comprendono due o tre principi attivi somministrati contemporaneamente.
Esistono anche farmaci da assumere per via generale che sono capaci di abbassare efficacemente la pressione oculare.
I vantaggi della terapia farmacologica consistono nella sua relativa innocuità che si associa ad una efficacia spesso soddisfacente.
Gli svantaggi sono legati principalmente alla scomodità di istillazioni multiple giornaliere, agli eventuali effetti collaterali fastidiosi ed al suo costo.
La terapia medica espone anche al pericolo che alcuni pazienti meno diligenti non la eseguano correttamente o la trascurino per alcuni periodi esponendosi così a pericolosi periodi di ipertensione oculare.
Concetti attuali sulla terapia medica combinata del glaucoma
La dinamica dell'umore acqueo e la pressione intraoculare dell'occhio glaucomatoso può essere affrontata in quattro modi:
La molteplicità dell'innervazione autonoma della
dinamica dell'umore acqueo presenta diversi meccanismi farmacologici per
influenzare la pressione intraoculare. I farmaci antiglaucomatosi, sotto
questo profilo, offrono, almeno teoricamente, molte potenziali associazioni
di terapia farmacologica. Tuttavia, non tutte le associazioni farmacologiche
sono logiche, realizzabili e tollerabili. Alla luce delle attuali possibilità
chirurgiche, il concetto di massima terapia medica deve essere ridefinito o
va sostituito da una chirurgia del glaucoma più precoce. Senza dubbio, nel
caso che la monoterapia medica sia insufficiente per controllare la PIO, la
terapia medica combinata può portare ad un progresso nella riduzione della
PIO. Nondimeno, aggiungere un altro farmaco al primo non dà un'additività
completa, come ci si attenderebbe considerando la risposta farmacologica
separata di ciascuna sostanza.
L'additività dipende in primo luogo dal fatto che le sostanze combinate
utilizzate riducano la pressione con meccanismi diversi d'azione. Una prova
unilaterale del farmaco spesso è utile sotto questo rispetto, comparando la
monoterapia rispetto alla terapia combinata con un esperimento clinico
intraindividuale.
Quale riduzione della PIO ci si può attendere dalla
terapia medica?
E' corretto presumere una diminuzione della PIO rispetto alla linea di base
con:
Qualora siano prese in considerazione "associazioni farmacologiche fisse", quali sono i vantaggi?
Quest'opzione deve essere comparata con le associazioni farmacologiche ottenute somministrando preparazioni separate, che offrono anche alcuni vantaggi:
Quali preferenze devono essere prese in considerazione, nel caso che principi attivi diversi siano associati in una singola preparazione farmaceutica?
Si possono avere gli stessi risultati sulla dinamica dell'acqueo, anche se dovuti ad un meccanismo di azione diverso:
Additività comprovate:
Additività dubbia:
Additività sinergica (tuttavia è una formulazione antiquata):
Antagonismo probabile:
Quale tipo di principio attivo dovrebbe essere evitato nelle associazioni in presenza delle seguenti condizioni?
Una terapia del glaucoma a lungo termine dovrebbe essere presa in considerazione con prudenza se si usano:
La terapia del glaucoma cronico con un angolo della camera anteriore stretto mediante associazione di farmaci deve:
C'è ancora posto per la tradizionale "massima terapia medica"? Le implicazioni sfavorevoli della massima terapia medica sulla prognosi di una chirurgia filtrante rappresentano delle buone ragioni per la revisione di questo concetto.
Ricordare i seguenti aspetti del problema, prima di instaurare una
"massima terapia medica":
Buoni motivi per limitare la massima terapia medica sono:
Associare due farmaci appare convincente; tuttavia, una chirurgia anticipata dovrebbe essere preferita ai vecchi concetti di massima terapia medica, includendo fino a quattro farmaci diversi.
La disponibilità dei moderni laser oftalmici permette oggi di eseguire degli interventi non cruenti dotati di discreta efficacia nel controllo dei glaucomi.
Il laser YAG al neodimio viene usato per praticare iridotomie, indicate nelle forme da chiusura d'angolo.
Il laser ad Argon ed altri laser termici vengono invece impiegati soprattutto per praticare la Trabeculoplastica, indicata nelle forme ad Angolo Aperto e la gonioplastica di uso più raro.
In alcuni casi puo' essere attuata una terapia con il laser che non prevede l'impiego di incisioni. In altri casi e' indispensabile effettuare un'incisione nell'occhio per creare un nuovo canale di scarico.
Nei casi che rispondono male alla terapia medica e nei casi in cui essa non sia praticabile, si può ricorrere alla
Attualmente la operazione più usata é la trabeculoctomia che consiste essenzialmente nel praticare un tunnel intrasclerale il quale permette all'umore acqueo di filtrare al di sotto della congiuntiva. Questa operazione, nelle sue varianti, é efficace nell'80% dei casi, ma espone ad alcune complicazioni di cui la più frequente é la formazione di una cataratta.
In caso di fallimento della trabeculectomia si ricorre ad altri interventi i cui risultati sono meno brillanti. Quando coesistono un glaucoma ed una cataratta é possibile ricorrere ad interventi che risolvono entrambi i problemi.
Le complicanze di tali interventi sono rare ma e' possibile che si
verifichino infezioni oculari o cataratta. Nella maggioranza dei casi gli
interventi descritti riescono ad impedire l'evoluzione della malattia verso
la cecità.
La perdita della vista e' prevenibile
Ogni persona di eta' superiore a 40 anni e i soggetti piu' giovani
appartenenti a famiglie a rischio dovrebbero effettuare un controllo
completo dall'oculista ogni 2 anni in modo da scoprire l'eventuale presenza
di glaucoma. L'oculista dovra' essere consultato immediatamente allorche'
siano presenti alcuni dei sintomi descritti. Quando viene fatta una diagnosi
precoce la pressione oculare puo' essere posta sotto controllo ed i danni
conseguenti al glaucoma possono essere prevenuti.
Come informare un paziente che ha il glaucoma?
Il Glaucoma è una malattia grave ma spesso asintomatica e può portare alla cecità. Pertanto, è essenziale che il paziente sia ben conscio di tutti gli effetti della malattia e delle diverse terapie disponibili. Di seguito verranno chiariti i punti più importanti che devono essere spiegati al paziente al momento della diagnosi e suggerite le linee guida su come fornire queste informazioni individualmente.
|
Il glaucoma è un'alterazione che potenzialmente può
rendere ciechi. Colpisce il 2% della popolazione, ed è causa del 15% di
cecità nel Regno Unito. Per converso, rimane asintomatico sino a quando
arriva allo stadio terminale, con perdita massiva del campo visivo
periferico. Una volta posta la diagnosi, il paziente è destinato a rimanere
in terapia e sotto controllo per tutta la vita. Molti pazienti non riescono
a capire perché sia necessario un controllo terapeutico strettissimo e
sottoporsi a visite periodiche in centri specializzati, dato che si sentono
in piena salute. Questo articolo tratta i punti essenziali che vanno
discussi col paziente, una volta posta la diagnosi di glaucoma.
Il Paziente
È fondamentale capire cosa si aspetta il paziente. Molti pazienti si
sentono imbarazzati davanti al medico e possono non capire le spiegazioni
che vengono loro date, ma non fanno domande perché non vogliono sembrare
stupidi. Tendono a dimenticare le informazioni ricevute e tanto più viene
loro detto, tanto meno ricordano.
Il medico
La qualità del rapporto medico-paziente è stata individuata come fattore
essenziale per l'informazione e la compliance del paziente. Alcuni studi
hanno evidenziato un legame tra la soddisfazione del paziente nei confronti
del rapporto col medico e la successiva compliance al trattamento.
Ovviamente, il medico che pone la diagnosi ha grande familiarità con la
malattia, nella fattispecie il glaucoma, in quanto ha a che fare
continuamente con questo problema. Avendo una conoscenza strutturata del
glaucoma, il medico spesso può essere troppo omissivo e lacunoso nella sua
spiegazione e usare un gergo specialistico, che è completamente desueto per
il paziente.
Il colloquio
Per favorire l'intesa con il paziente, è opportuno usare parole semplici e
frasi concise, lasciandogli ampio spazio per fare domande; aiutarsi con
degli schemi può essere molto utile. Poiché è verosimile che il paziente
si dimentichi gran parte di quanto gli viene detto, va data la priorità ai
punti più importanti. La ripetizione è una importante, spesso essenziale,
componente del colloquio. Concedere tempo e avere un atteggiamento
amichevole può aiutare il paziente a rilassarsi e ad acquisire più
informazioni. Idealmente, al termine del colloquio il paziente dovrebbe
andarsene avendo piena coscienza di cosa implica avere un glaucoma, ma anche
con un atteggiamento positivo di autocontrollo nei riguardi della sua
malattia.
Avendo ben presente quanto sopra detto, quali sono le domande più frequenti
che vengono fatte?
Cos'è il glaucoma?
Allo scopo di far capire bene al paziente quali sono le conseguenze di un
glaucoma, innanzitutto è necessario che egli comprenda che cosa non va. Ciò
comporta una spiegazione con parole semplici della fisiopatologia del
glaucoma, cioè che l'aumentata pressione oculare porterà ad una lesione
del nervo ottico e conseguente riduzione della visione. In questa fase,
usare una terminologia clinica complicata genera soltanto confusione nel
paziente, mentre qualche semplice schema può essere di grande aiuto. Sono
anche utili degli opuscoli che spieghino la situazione, in quanto il
paziente può rileggerli con comodo a casa sua.
Diventerò cieco?
Questa è la paura più grande del paziente. Davanti ad un paziente
asintomatico, con un campo visivo praticamente normale, è l'occasione
ideale per sottolineare che, senza terapia, il glaucoma è una malattia che
può portare alla cecità e per richiamare l'attenzione sulla necessità e
sull'utilità che la terapia prescritta sia eseguita scrupolosamente. Per i
pazienti con malattia già in stadio avanzato, la prognosi per il futuro
deve essere posta in modo realistico ma anche positivo e confortante.
Quali sono le possibilità terapeutiche disponibili?
Il discorso dovrebbe elencare molto brevemente le possibilità mediche,
laser e chirurgiche di trattamento del glaucoma. Troppi particolari danno il
solo risultato di confondere il paziente, anche se è necessario lasciargli
ogni opportunità, se lo desidera, di discutere ciascuna opzione. È
opportuno scendere in maggiori particolari per la soluzione che, in quella
fase, s'intende adottare.
Quali sono gli effetti collaterali?
Questa domanda è la logica conseguenza della precedente, ed è necessario
spiegare al paziente pro e contro di ciascun tipo di terapia e quali sono i
più comuni effetti collaterali associati all'uso della terapia scelta, in
modo da ottenere il massimo della compliance sul lungo termine.
Con che frequenza è necessario farsi controllare?
È indispensabile che il paziente capisca che il glaucoma richiede controlli
per tutta la vita e che la loro frequenza dipende da come la malattia
risponde alla terapia. Poiché spesso il glaucoma è asintomatico, deve
essere ben chiarito che il non sottoporsi ai controlli previsti può
comportare una progressione della malattia e conseguente perdita di funzione
visiva, senza che il paziente se ne renda conto, se non quando è troppo
tardi.
Posso continuare a guidare?
La risposta a questa domanda può cambiare a seconda del paese. Nel Regno
Unito l'oftalmologo ha l'obbligo legale di comunicare al paziente che egli
deve informare le autorità preposte al rilascio della patente che egli è
affetto da glaucoma. A questo punto sta all'autorità chiedere un esame del
campo visivo e determinare se il paziente ha ancora i requisiti previsti
dalla legge per guidare. Tuttavia, in funzione del segreto professionale,
l'oculista non ha l'obbligo di informare le autorità qualora il paziente
continui a guidare pur non avendo i requisiti minimi richiesti, a meno che
il medico non ritenga che il comportamento del paziente ponga altre persone
a rischio grave.
Qual è il rischio per la mia famiglia?
Un'anamnesi familiare positiva, se è affetto uno dei genitori, raddoppia il
rischio relativo, se è affetto un fratello lo quadruplica. Pertanto, il
paziente deve essere avvisato che è opportuno che tutti i suoi consanguinei
di primo grado dall'età di 40 anni facciano controllare una volta all'anno
la pressione oculare. Nel Regno Unito l'importanza di questo fattore di
rischio è stata riconosciuta, mantenendo la gratuità degli esami
funzionali per le persone che hanno un'anamnesi familiare positiva.
Supporti per il colloquio
Le informazioni importanti possono essere consolidate usando stampati, che
il paziente può leggersi a casa. Una "infermiera del glaucoma",
addestrata a discutere della malattia e con la quale spesso i pazienti si
sentono più a loro agio, può discutere la situazione col paziente in modo
meno formale. Ciò può essere fatto sia nella stessa visita, o meglio,
durante quella successiva di controllo, verificando che il paziente sappia
come usare correttamente la sua terapia e segua scrupolosamente il
trattamento prescritto. Inoltre si può porre il paziente in contatto con
gruppi di sostegno, quali, nel Regno Unito, l'Associazione Internazionale
del Glaucoma.